TUTORIALPELAJARAN.COM – Bagaimana model atom Bohr menjelaskan posisi elektron dalam suatu atom? Mari bahas bersama pertanyaan ini dengan menyimak tulisan berikut ini.
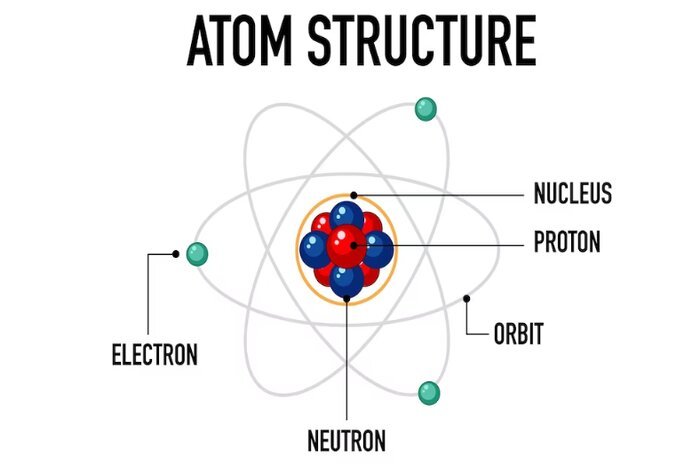
Model atom Bohr, yang diperkenalkan oleh fisikawan Denmark Niels Bohr pada tahun 1913, merupakan salah satu model atom pertama yang berhasil menjelaskan sebagian besar sifat spektrum atom hidrogen dan memberikan pemahaman awal tentang distribusi elektron dalam atom.
Model ini memiliki beberapa fitur penting:
1. Orbit Stasioner
Menurut model Bohr, elektron dalam suatu atom hanya bisa berada dalam orbit stasioner atau orbit yang tetap. Elektron tidak akan mengalami radiasi energi saat berada dalam orbit ini.
Oleh karena itu, orbit-bercerai dari model atom Rutherford yang sebelumnya diajukan.
2. Orbit Kuantisasi Energi
Model Bohr memperkenalkan konsep kuantisasi energi, yang berarti bahwa hanya beberapa orbit yang diizinkan bagi elektron untuk mengelilingi inti atom. Setiap orbit memiliki tingkat energi yang tetap dan terdefinisi.
3. Pergeseran Spektrum Hidrogen
Salah satu pencapaian penting dari model Bohr adalah kemampuannya untuk menjelaskan pola spektrum atom hidrogen, yang sebelumnya sulit dijelaskan oleh model atom klasik.
Model Bohr menjelaskan bahwa ketika elektron berpindah dari orbit energi yang lebih tinggi ke orbit energi yang lebih rendah, energi dipancarkan dalam bentuk cahaya dengan frekuensi tertentu. Ini sesuai dengan garis spektrum yang diamati dalam spektroskopi.
4. Formula Frekuensi
Model Bohr menghubungkan frekuensi cahaya yang dipancarkan atau diserap oleh atom dengan perbedaan energi antara orbit elektron. Formula ini dikenal sebagai Persamaan Frekuensi Bohr:
ΔE = hf
di mana ΔE adalah perubahan energi, h adalah konstanta Planck, dan f adalah frekuensi cahaya.
Meskipun model Bohr memberikan kontribusi besar dalam pemahaman awal tentang atom, model ini memiliki batasan.
Model ini hanya cocok untuk atom hidrogen dan atom dengan satu elektron. Pada atom yang lebih kompleks, seperti atom dengan banyak elektron, model ini tidak mampu menjelaskan secara akurat distribusi elektron dan perilaku spektrum.
Model mekanika kuantum yang lebih canggih akhirnya menggantikan model atom Bohr dan memberikan pemahaman yang lebih komprehensif tentang sifat partikel dan gelombang elektron dalam atom.***