Suatu sistem kesetimbangan dapat berubah, jika mendapat pengaruh dari luar. Perubahan tersebut bertujuan untuk mencapai kesetimbangan baru, sehingga disebut pergeseran kesetimbangan. Hal ini sesuai dengan hasil penelitian yang dilakukan oleh Henry Louis Le Chatelier.
Pada tahun 1884,Henri Louis Le Chatelier berhasil menyimpulkan pengaruh faktor luar terhadap kesetimbangan dalam suatu asas yang dikenal dengan asas Le Chatelier sebagai berikut: Bila pada sistem kesetimbangan diadakan aksi, maka sistem akan mengadakan reaksi sedemikian rupa sehingga pengaruh aksi itu menjadi sekecil-kecilnya. Secara singkat,asas Le Chatelier dapat disimpulkan sebagai berikut: Reaksi = -Aksi.
Faktor-Faktor Yang Mempengaruhi Arah Pergeseran Kesetimbangan
1.Konsentrasi
Berdasarkan Asas Le Chatelier, apabila konsentrasi pereaksi atau produk reaksi berubah, maka kesetimbangan akan bergeser untuk mengurangi pengaruh perubahan konsentrasi yang terjadi sampai diperoleh kesetimbangan yang baru. Untuk mempelajari pengaruh perubahan konsentrasi pada kesetimbangan, perhatikan percobaan penambahan ion-ion dan zat lain pada sistem kesetimbangan berikut.

Pada percobaan ini didapat bahwa penambahan ion Fe3+ dan SCN– menyebabkan larutan standar menjadi lebih pekat, ion Fe(SCN)2+ bertambah. Pada kesetimbangan ini adanya penambahan ion Fe3+ dan ion SCN– menyebabkan kesetimbangan bergeser ke arah ion Fe(SCN)2+. Pada penambahan ion OH– mengakibatkan warna merah pada larutan berkurang, sebab jumlah ion Fe(SCN)2+ berkurang. Mengapa ion Fe(SCN)2+ berkurang? Ion OH– berfungsi untuk mengikat ion Fe3+, maka untuk menjaga kesetimbangan, ion Fe(SCN)2+ akan terurai lagi membentuk ion Fe3+ dan SCN– atau kesetimbangan bergeser ke arah ion Fe3+ dan SCN–
Berdasarkan asas Le Chatelier :
- Jika pada sistem kesetimbangan salah satu komponen ditambah, kesetimbangan akan bergeser ke arah yang berlawanan.
- Jika pada sistem kesetimbangan salah satu komponennya dikurangi, kesetimbangan akan bergeser ke arah komponen tersebut.
2. Suhu
Kesetimbangan reaksi juga dapat bergeser karena pengaruh suhu.
Untuk mempelajari pengaruh perubahan suhu pada kesetimbangan. Perhatikan reaksi kesetimbangan hasil percobaan lempeng Cu dengan HNO3 pekat berikut:

Keterangan:
Tabung 1. Tabung reaksi diletakkan di air panas
Tabung 2. Tabung reaksi diletakkan di air dingin
Tabung 3. Sebagai control/pembanding
Berdasarkan percobaan, apabila suhu diturunkan, gas menjadi tidak berwarna dan kesetimbangan bergeser kearah N2O4 yang tidak berwarna (kearah eksoterm dengan melepaskan kalor). Apabila suhu dinaikkan gas berwarna coklat, karena kesetimbangan bergeser ke arah NO2 yang berwarna coklat (kearah endoterm dengan cara menyerap kalor).
Berdasarkan asas Le Chatelier :
- Apabila suhu reaksi dinaikkan (kalor bertambah), maka sistem akan menyerap kalor tersebut. Kesetimbangan akan bergeser ke arah reaksi endoterm.
- Apabila suhu reaksi diturunkan (kalor berkurang), maka sistem akan melepaskan kalor tersebut. Kesetimbangan akan bergeser ke arah reaksi eksoterm.
Pada reaksi kesetimbangan, apabila reaksi ke kanan menyerap kalor (bersifat endoterm), maka reaksi ke kiri akan melepas kalor (bersifat eksoterm) demikian pula sebaliknya.
3. Tekanan dan Volume
Penambahan tekanan akan memperkecil volume. Begitupun sebaliknya, memperkecil tekanan akan memperbesar volume. Sesuai dengan Asas Le Chatelier, dalam hal ini memperbesar tekanan/memperkecil volume dan memperkecil tekanan/memperbesar volume merupakan aksi yang diberikan lingkungan. Pemberian aksi ini akan menyebabkan sistem kesetimbangan akan terganggu. Untuk mengembalikan kondisi sistem kesetimbangan seperti semula (mempertahankan harga K) maka kesetimbangan haus mengadakan reaksi untuk membuat pengaruh aksi menjadi sekecil-kecilnya.
Perhatikanlah gambar berikut :
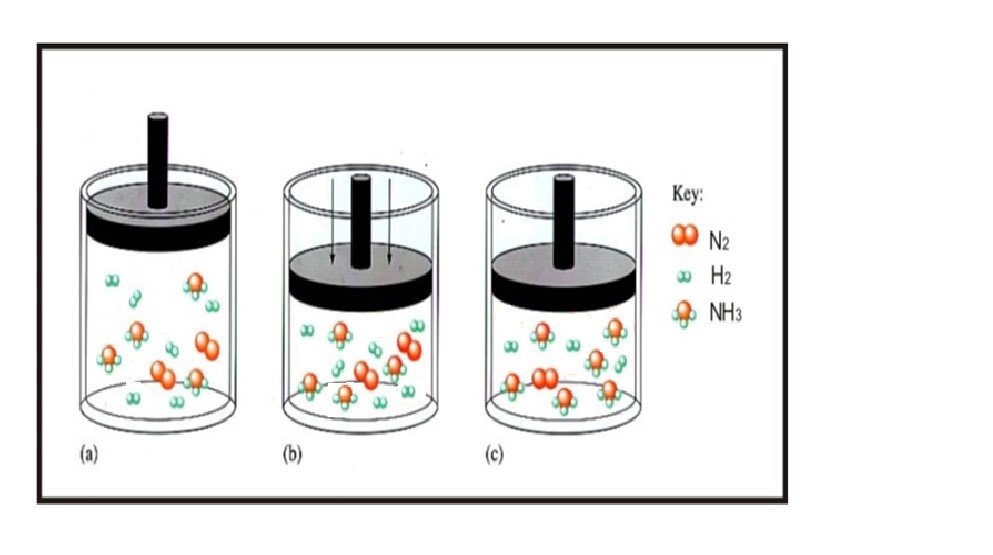
Gambar di atas merupakan gambar yang menunjukkan pengaruh volume dan tekanan pada kesetimbangan
N2 (g) + 3H2 (g) 2 NH3 (g)
- Campuran gas N2, H2, NH3 pada kesetimbangan
- Ketika tekanan ditingkatkan dengan memperkecil volume, campuran tidak lagi setimbang (Qc < Kc)
- Reaksi bergeser ke arah kanan, jumlah total molekul gas menurun sampai kesetimbangan tercapai kembali (Qc = Kc).
Pada gambar diatas ditunjukkan bahwa sistem mengadakan reaksi berupa memperbanyak produk yang terbentuk, alhasil pada keadaan (c), yaitu saat kesetimbangan kembali tercapai, jumlah molekul produk bertambah dan jumlah molekul perekatan berkurang. Kita tentu sudah mengetahui sebelumnya bahwa jumlah koefisien menunjukkan jumlah mol . Ketika kita memperbesar tekanan dengan memperkecil volume, maka keadaan molekul pada sistem akan berdesak-desakan. Untuk mengembalikan sistem ke keadaan normal kembali adalah dengan cara memperkecil jumlah molekul dalam sistem. Hal inilah yang dilakukan sistem yaitu dengan menggeser reaksi ke arah reaksi yang menghasilkan jumlah molekul lebih sedikit, dalam hal ini adalah ke arah kanan (pembentukan NH3 ). Dengan demikian, hasilnya jumlah molekul NH3 lebih banyak dan molekul pereaksi yaitu N2 dan H2 sedikit, sehingga Qc akan sama dengan Kc atau sistem dalam keadaan setimbang.
Berdasarkan asas Le Chatelier :
- Jika tekanan diperbesar (volume diperkecil), maka kesetimbangan akan bergeser ke arah jumlah koefisien reaksi kecil.
- Jika tekanan diperkecil (volume diperbesar), maka kesetimbangan akan bergeser ke arah jumlah koefisien reaksi besar.
4. Katalis
Dalam reaksi kesetimbangan, katalis tidak menggeser kesetimbangan, katalis hanya mempercepat tercapainya keadaan setimbang dan tidak merubah letak kesetimbangan (harga tetapan kesetimbangan, K tetap), hal ini disebabkan katalis hanya mempercepat reaksi ke kanan dan ke kiri sama besar.
Katalis hanya mempercepat reaksi untuk mencapai kesetimbangan (Bandingkan 2 grafik profil konversi reaksi versus waktu reaksi yang diilustrasikan pada gambar di bawah ini. Reaksi yang menggunakan katalis jauh lebih cepat mencapai kesetimbangan dibandingkan dengan reaksi tanpa katalis).
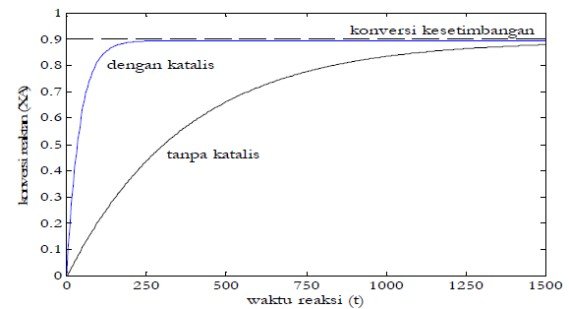
Karena tetapan kesetimbangan reaksi (K) yang merupakan perbandingan antara tetapan kecepatan reaksi ke kanan terhadap tetapan kecepatan reaksi ke kiri tidak mengalami perubahan, maka katalis bersifat mempercepat reaksi dalam kedua arah. Artinya, katalis yang mempercepat reaksi ke kanan juga akan mempercepat reaksi ke kiri (reaksi balik).













