Dalam kehidupan sehari-hari, jika kita mengamati benda-benda logam yang ada di lingkungan kita, misalnya pagar, pisau, paku, kawat, kerangka gedung bertingkat, kapal, dan berbagai jenis kendaraan, tampak adanya kecenderungan kerusakan pada logam tersebut. Proses perusakan pada permukaan logam yang disebabkan oleh reaksi kimia disebut korosi.
1.Pengertian Korosi
Korosi adalah reaksi redoks antara suatu logam dengan berbagai zat di lingkungannya yang menghasilkan senyawa-senyawa yang tidak dikehendaki. Sebagian besar orang mengartikan korosi sebagai karat. Sebenarnya, karat adalah salah satu jenis korosi yang dikhususkan untuk bahan logam, yang sangat lazim terjadi pada besi. Berbagai jenis logam banyak kita gunakan untuk berbagai peralatan sehingga korosi sama dengan penurunan mutu dari peralatan logam tersebut.
2.Faktor-faktor yang Mempercepat Korosi
Peristiwa korosi juga bisa dikatakan proses elektrokimia, yaitu proses (perubahan / reaksi kimia) yang melibatkan adanya aliran listrik. Bagian tertentu dari besi berlaku sebagai kutub negatif (elektroda negatif, anoda), sementara bagian yang lain sebagai kutub positif (elektroda positif, katoda). Elektron mengalir dari anoda ke katoda, sehingga terjadilah peristiwa korosi.
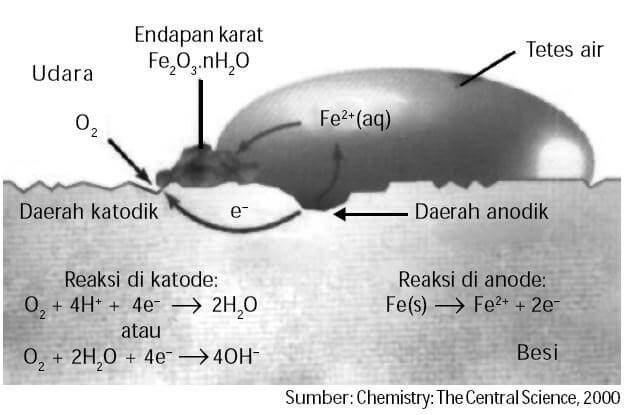
Korosi atau proses pengaratan merupakan proses elektrokimia. Pada proses pengaratan, besi (Fe) bertindak sebagai pereduksi dan oksigen (O2) yang terlarut dalam air bertindak sebagai pengoksidasi
Reaksi korosi dapat terjadi kalau di dalam suatu logam terdapat katoda, anoda dan elektrolit, serta aliran eksternal. Kalau salah satu dari komponen tersebut tidak terdapat di dalam suatu logam, maka tidak akan terjadi reaksi korosi. Misalnya kalau tidak terdapat uap air atau air di dalam permukaan suatu logam besi, maka tidak akan terdapat reaksi korosi di dalam logam besi tersebut. Demikian pula halnya, kalau di dalam besi yang sangat murni sekali, meskipun di dalamnya terdapat cukup banyak air, maka tidak akan terjadi korosi di dalam logam besi tersebut. Unsur oksigen juga memegang peranan yang sangat penting di dalam proses besi menjadi oksida besi.
Korosi pada permukaan logam merupakan proses yang mengandung reaksi redoks. Reaksi yang terjadi ini merupakan sel volta mini. Sebagai contoh, korosi besi terjadi apabila ada oksigen (O2) dan air (H2O) . Logam besi tidaklah murni, melainkan mengandung campuran karbon yang menyebar secara tidak merata dalam logam tersebut. Hal tersebut menimbulkan perbedaan potensial listrik antara atom logam dengan atom karbon (C). atom logam besi (Fe) bertindak sebagai anode dan atom C sebagai katode. Oksigen dari udara yang larut dalam air akan tereduksi, sedangkan air sendiri berfungsi sebagai media tempat berlangsungnya reaksi redoks pada peristiwa korosi. Jika jumlah H2O dan O2 yang mengalami kontak dengan permukaan logam semakin banyak, maka semakin cepat berlangsungnya korosi pada permukaan logam tersebut.
3. Reaksi Perkaratan
Ditinjau secara elektrokimia, proses perkaratan besi merupakan peristiwaterokisdasinya logam besi oleh oksigen yang berasal dari udara.
Reaksi yang terjadi pada perkaratan besi adalah:
Anoda : Fe(s) ® Fe2+(aq) + 2e– (x2)
Katoda : O2(g) + 2H2O(l) + 4e– ® 4OH–
Reaksi sel : 2Fe(s) + O2(g) +2H2O(l) ® 2Fe2+(aq) +4OH–(aq)
Ion Fe2+ tersebut kemudian akan mengalami oksidasi lebih lanjut dengan reaksi:
4Fe2+ + O2(g) +(4 + 2n)H2O(l) ® 2Fe2O3. nH2O + 8H+(aq)
4.Cara-Cara Mencegah Korosi
Korosi menimbulkan banyak kerugian karena mengurangi umur berbagai barang atau bangunan yang menggunakan besi atau baja. Cara-cara mencegah terjadinya korosi didsarkan pada 2 hal yaitu korosi besi membutuhkan oksigen dan air sehingga dalam mencegah korosi, logam harus dihindarkan kontak langsung dengan air dan oksigen dan berbagai jenis logam dapat melindungi logam lain seperti besi terhadap korosi. Ada beberapa cara yang dapat dilakukan untuk mencegah terjadinya korosi berdasarkan kedua hal tersebut , yaitu:
- Pelapisan dengan bahan atau zat lain
1.Pengecatan pada logam besi
Besi yang dicat akan terlindung dari kontak dengan air dan gas oksigen yang banyak terdapat di udara. Contohnya pengecatan pada jembatan dan pagar.
2.Melumuri dengan oli atau gemuk
Oli atau gemuk mencegah kontak besi dengan air. Cara ini diterapkan untuk perkakas dan mesin.
3.Dibalut dengan plastik
Plastik mencegah kontak besi dengan udara dan air. Contohnya pada rak piring dan keranjang sepeda.
- Pelapisan dengan logam-logam lain (Dengan cara elektrolisis)
1.Tin Plating (pelapisan dengan timah)
Pelapisan ini dilakukan secara elektrolisis,yang disebut elektroplanting. Timah tergolong logam yang tahan karat. Besi yang dilapisi timah tidak mengalami korosi karena tidak ada kontak dengan oksigen (udara) dan air. Pelapisan ini hanya melindungi besi selama lapisan besi utuh. Apabila lapisan timah ada pada kaleng yang rusak, misalnya tergores, maka timah justru mendorong/mempercepat korosi besi. Hal itu terjadi karena potensial reduksi besi lebih negatif daripada timah (E0 Fe = -0,44 volt; E0 Sn = -0,14 volt). Oleh karena itu, besi yang dilapisi dengan timah akan membentuk suatu sel elektrokimia dengan besi sebagai anode. Dengan demikian timah mendorong korosi besi. Akan tetapi, hal ini justru yang diharapkan, sehingga kaleng-kaleng bekas cepat hancur.
2.Cromium planting (pelapisan dengan kromium)
Besi atau baja juga dapat dilapisi dengan kromium untuk memberi lapisan pelindung yang mengkilap, contohnya untuk bumper mobil.
3. Galvanisasi (pelapisan dengan zink)
Zink dapat melindungi besi dari korosi sekalipun lapisannya tidak utuh. Hal ini karena suatu mekanisme yang disebut perlindungan katode. Contohnya pelapisan zink pada pipa besi, tiang telpon, dan badan mobil.
4. Sacrificial protection (pengorbanan anode)
Besi yang dihubungkan dengan logam lain yang lebih aktif (mempunyai potensial elektrode lebih negatif atau lebih mudah berkarat) membentuk sel elektrokimia dengan besi sebagai katode. Dengan demikian yang akan teroksidasi adalah logam lain itu(anode) sedangkan besi hanya berfungsi sebgaia tempat terjadinya reduksi oksigen. Jadi, besi terlindung karena dijadikan katode, sedangkan logam pelindungnya (anode) dikorbankan. Perlindungan katode digunakan untuk melindungi pipa bawah tanah. Pada tempat-tempat tertentu pipa itu dihubungkan dengan logam magnesium. Magnesium akan teroksidasi sehingga perlu diganti secara berkala.
Cara ini digunakan untuk melindungi pipa baja yang ditanam dalam tanah atau badan kapal laut.
Magnesium
Pada cara pengorbanan anode, logam magnesium mengalami oksidasi dengan reaksi:
Mg(s) → Mg2+ + 2e– .
Sedangkan yang mengalami reduksi adalah oksigen, dengan reaksi:
O2(g) + 4H+(aq) + 4e– → H2O(l)
5. Membuat paduan logam
Paduan logam yang sering dipakai adalah stainless steel, yang merupakan campuran dari 74% besi, 18% nikel dan 8% krom. Contohnya pada alat-alat perkakas rumah tangga seperti panci, sendok dan garpu serta gunting.