 Apakah kamu pernah melihat petir? Biasanya petir muncul pada musim hujan. karena pada musim hujan udara mengandung kadar air yang lebih tinggi sehingga daya isolasinya turun dan arus lebih mudah mengalir. Petir terjadi melalui proses kesetimbangan. Awalnya terlihat kilatan cahaya sesaat yang menyilaukan dari langit. Kemudian disusul dengan suara menggelegar. Petir terjadi akibat perpindahan elektron antar awan dan bumi. Energi yang dilepaskan berupa cahaya, panas, dan bunyi. Energi panas yang dilepaskan saat terjadi petir berpengaruh pada konsentrasi gas NO di atmosfer.Mengapa hal ini bisa terjadi? Reaksi pembentukan gas No sebagai berikut.
Apakah kamu pernah melihat petir? Biasanya petir muncul pada musim hujan. karena pada musim hujan udara mengandung kadar air yang lebih tinggi sehingga daya isolasinya turun dan arus lebih mudah mengalir. Petir terjadi melalui proses kesetimbangan. Awalnya terlihat kilatan cahaya sesaat yang menyilaukan dari langit. Kemudian disusul dengan suara menggelegar. Petir terjadi akibat perpindahan elektron antar awan dan bumi. Energi yang dilepaskan berupa cahaya, panas, dan bunyi. Energi panas yang dilepaskan saat terjadi petir berpengaruh pada konsentrasi gas NO di atmosfer.Mengapa hal ini bisa terjadi? Reaksi pembentukan gas No sebagai berikut.
N2(g) + O2(g) –> 2NO(g)
Reaksi di atas termasuk kesetimbangan endoterm. Pada suhu dan tekanan normal reaksi kesetimbangan bergeser ke kiri dan hampir tidak ada gas NO yang terbentuk. Energi panas yang besar dilepaskan oleh petir dan mengakibatkan reaksi kesetimbangan bergeser jauh ke kanan. Gas NO yang terbentuk larut dalam air hujan dan diserap oleh tanah. Tanaman menyerap NO yang larut dalam air hujan sebagai senyawa penting untuk pertumbuhan. Selain contoh di atas, masih banyak lagi fenomena alam yang melibatkan reaksi kesetimbangan kimia.
- Reversibel dan Ireversibel
Reaksi reversible merupakan reaksi yang dapat balik, sedangkan reaksi irreversible merupakan reaksi yang tidak dapat balik. Contoh reaksi ireversible adalah kertas terbakar dan juga reaksi
NaOH (aq) + HCl (aq) –> NaCl(aq) + H2O(l).
Reaksi antara natrium hidroksida (NaOH) dan asam klorida (HCl) hanya dapat berlangsung ke arah kanan. Hal ini dapat ditunjukkan dengan cara mereaksikan kembali hasil reaksi, yaitu NaCl dan H2O. Fakta menunjukkan bahwa NaCl tidak akan bereaksi dengan air membentuk NaOH dan HCl. Adapun contoh reaksi reversibel adalah reaksi antara N2 dan H2 menjadi NH3, dan sebaliknya NH3 dapat terurai menjadi H2dan N2.
- Keadaan Setimbang
Misalkan terdapat 1 mol gas nitrogen dipanaskan bersama 3 mol gas hidrogen. Pada awalnya hanya terjadi satu reaksi yaitu pembentukan ammonia.
N2(g) + 3H2(g) —> 2NH3(g)
Ternyata sebagian ammonia akan terurai kembali menjadi gas nitrogen dan gas hidrogen.
2NH3(g) —-> N2(g) + 3H2(g)
Selanjutnya kedua reaksi tersebut akan berlangsung secara bersama-sama menurut reaksi dapat balik berikut ini.
N2(g) + 3H2(g) 2NH3(g)
Misalkan laju reaksi maju v1 dan laju reaksi balik v2. Sebagai mana telah dipelajari dalam laju reaksi, nilai v1 bergantung pada konsentrasi N2 dan H2 (laju pembentukan amoniak), sedangkan nilai v2 bergantung pada konsentrasi NH3 (laju penguraian amoniak). Pada awal reaksi v1 mempunyai nilai maksimum sedangkan v2 adalah nol karena NH3 belum terbentuk. Pada suatu saat (pada saat waktu t tertentu) laju reaksi maju akan sama dengan laju reaksi balik. Selanjutnya seiring dengan berkurangnya konsentrasi N2 dan H2, nilai v1 semakin lama semakin kecil. Sebaliknya dengan bertambahnya konsentrasi NH3 maka nilai v2 akan semakin besar. Peristiwa ini dapat digambarkan pada kurva sebagai berikut:
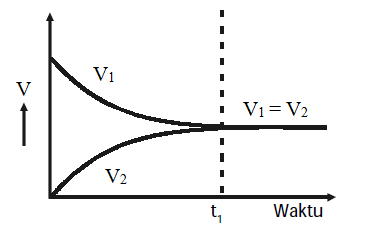
Kurva 1 : Perubahan laju reaksi terhadap waktu. v1 = laju reaksi dari kiri ke kanan (laju pembentukan amoniak) dan v2 = laju reaksi dari kanan ke kiri (laju penguraian amoniak)

Kurva 2: Perubahan konsentrasi pereaksi dan hasil reaksi terhadap waktu menuju keadaan setimbang.
Dari kedua kurva di atas dapat dilihat, sejak pada waktu t v1= v2 jumlah masing-masing komponen tidak berubah terhadap waktu. Oleh karena itu tidak ada perubahan yang dapat diamati atau diukur (reaksi makroskopis) seolah-olah reaksi telah berhenti. Pada keadaan inilah reaksi telah mencapai keadaan setimbang.
Jadi keadaan setimbang adalah dimana laju pembentukan produk dan penguraian produk pada waktu tertentu bernilai sama sehingga konsentrasi pereaksi dan hasil reaksi tetap tidak berubah terhadap waktu tetap oleh karena itu tidak ada perubahan lagi yang dapat di amati.
Namun, melalui percobaan dapat ditunjukkan dalam keadaan setimbang tersebut reaksi tetap berlangsung pada tingkat molekul (tingkat mikroskopis). Artinya reaksi antara nitrogen dan hidrogen membentuk ammonia tetap berlangsung, demikian pula penguraian ammonia membentuk hidrogen dan nitrogen. Oleh karena itu kesetimbangan kimia disebut kesetimbangan dinamis.
Kesetimbangan dinamis adalah secara mikroskopis reaksi terus belangsung dengan laju pembentukan produk dan penguraian produk pada waktu tertentu bernilai sama sehingga konsentrasi pereaksi dan hasil reaksi tetap atau tidak berubah terhadap waktu.













