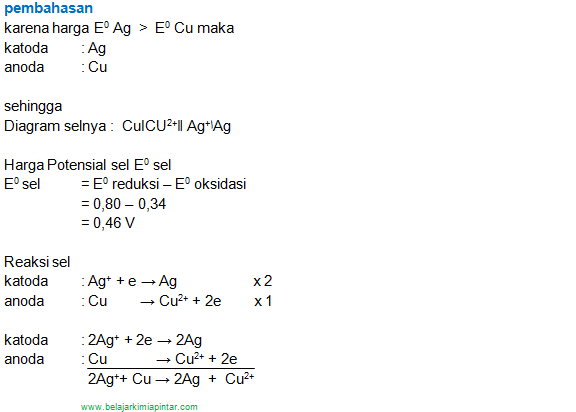Seorang ilmuwan Itali bernama Luigi Galvani telah melakukan sebuah percobaan. Percobaan yang dilakukan adalah melilit dua logam yaitu kawat besi dan kawat tembaga menjadi satu. Kemudian kedua ujung yang lainnya dikenakan pada kaki kodok dan kaki kodokpun bergerak. Peristiwa itu diberi istilah listrik hewan atau “animal elektricity”. Percobaan galvani ini merupakan asal mula ditemukannya sel kering, sel merkuri, accu, dan sumber tenaga listrik sejenis lainnya. Percobaan galvani ini kemudian diteruskan oleh Alessandro Guiseppe Volta. Sel-sel ini pada prinsipnya mengubah energi kimia menjadi listrik. Karena itu, sel listrik yang dihasilkan disebut sel galvanic atau sel volta. Sel-sel penghasil energi listrik yang sekarang berada dalam tingkat pengembangan ini merupakan sumber penghasil tenaga yang sangat penting dikemudian hari untuk dapat menggantikan sumber daya energi yang tidak dapat diperbaharui.
Prinsip-Prinsip Sel Volta
- Gerakan elektron dalam sirkuit eksternal akibat adanya reaksi redoks
- Terjadi perubahan: Energi kimia à energi listrik
- Pada Anoda : Elektron adalah produk dari reaksi Oksidasi dengan kutub Negatif
- Pada Katoda : Elektron adalah reaktan dari reaksi reduksi, dengan katoda pada kutub Positif
- Arus Elektron : Anoda –> Katoda
Arus Listrik : Katoda –> Anoda
Jembatan Garam : menyetimbangkan ion-ion dalam larutan
Konsep Sel Volta
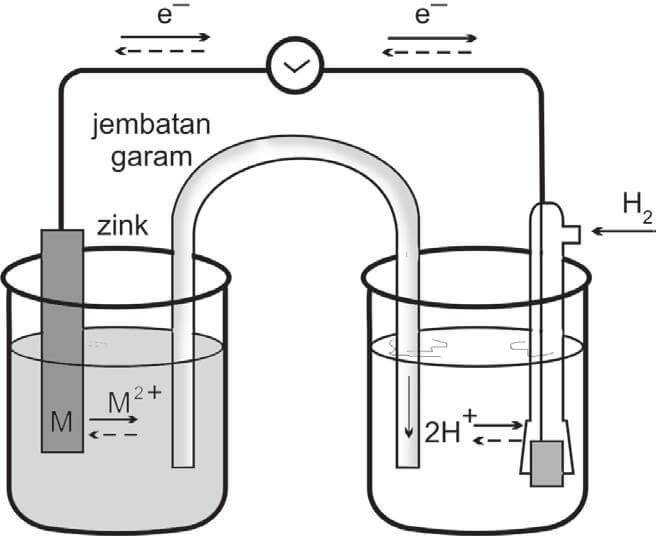
Pada sel Volta,anoda adalah kutub negatif dan katoda adalah kutub postif. Anoda dan katoda yang berupa logam dicelupkan kedalam larutan elektrolit yang mengandung masing-masing ion logamnya. Kedua larutan dihubungkan dengan jembatan garam, sedangkan kedua elektroda dihubungkan dengan kawat. Listrik yang dihasilkan diukur dengan Voltmeter yang dipasang pada kawat. Contoh reaksi redoks spontan dalam sel Volta yang menghasilkan energi listrik adalah reaksi antara seng dan tembaga.
Contoh Sel Volta :

Dalam rangkaian tersebut, logam seng dicelupkan dalam larutan ZnSO4 (mengandung Zn2+) dan logam tembaga dicelupkan dalam larutan CuSO4 (mengandung Cu2+). Logam seng akan semakin keropos karena larut menjadi Zn2+ yang disertai pelepasan elektron.
Reaksi : Zn(s) → Zn2+ + 2e
Elektron yang dilepaskan oleh logam seng mengalir melalui kawat penghantar menuju tembaga, selanjutnya diterima oleh ion Cu2+ yang kemudian mengendap sebagai logam tembaga.
Reaksi : Cu2+(aq) + 2 e →Cu (s)
Selama reaksi dalam rangkaian tersebut berlangsung, aliran elektron (arus listrik) terus terjadi. Agar pertambahan ion Zn2+ dan kelebihan ion SO42- karena berkurangnya Cu2+ maka ion tersebut dinetralkan dengan ion-ion dari jembatan garam. Pada rangkaian tersebut logam seng dan tembaga menjadi kutub-kutub listrik yang disebut elektroda. Pada logamyang mana terjadi reaksi reduksi dan pada logam yang mana terjadi oksidasi? Elektroda tempat terjadinya oksidasi disebut anoda sedangkan elektroda tempat terjadinya reaksi reduksi disebut katoda. Elektroda mana yang merupakan kutub positif dan mana yang merupakan kutub negatif? Pada logam seng terjadi pelepasan elektron (oksidasi) sehingga logam seng disebut sebagai anoda yang juga merupakan elektroda negatif, sedangkan pada logam tembaga terjadi reduksi Cu2+, sehingga logam tembaga disebut katoda yang juga merupakan elektroda positif.
Notasi Sel pada Sel Volta
Notasi/Diagram sel adalah notasi singkat yang menggambarkan terjadinya reaksi pada sel galvani atau sel volta. Dalam sel galvani reaksi-reaksi dalam dua kompartemen menghasilkan energi listrik. Reaksi yang terjadi pada setiap kompartemen disebut reaksi ½ sel. Untuk memberikan gambaran lengkap mengenai sel galvani, beberapa informasi perlu diberikan:
- Logam yang digunakan sebagai elektroda (macam-macam elektroda);
- Keadaan larutan (elektrolit) yang berhubungan dengan elektroda (termasuk konsentrasi ion dalam larutan);
- ½ sel yang mana yang anoda dan ½ sel yang mana yang katoda;
- Zat mana yang reaktan dan mana yang hasil reaksi.
Sebagai contoh adalah pada gambar.2 dapat dituliskan diagram selnya sebagai berikut:
- Pada anoda terdapat elektroda Zn yang mengalami oksidasi
Zn àZn2+ + 2e
Diagram ½ sel ini ditulis sebagai berikut:
Anoda :Zn / Zn2+
- Pada katoda terdapat elektroda Cu yang mengalami reduksi
Cu2++ 2e à Cu
Diagram ½ sel ini ditulis sebagai berikut:
Katoda : Cu2+ / Cu
Untuk menggambarkan sel Galvani atau sel volta secara lengkap digunakan sel diagram sebagai berikut: Zn | Zn2+ || Cu2+| Cu
Maka:
- Anoda selalu ditulis disebelah kiri dan katoda disebelah kanan.
- Tanda | menunjukkan reaksi yang terjadi pada elektroda
- Tanda || menunjukkan jembatan garam atau selaput semi permeabel.
Diagram pada sel galvani/volta dengan elektroda padat:
Reaksi sel : A + Bx+à A y+ + B
Diagram sel : A | A y+ || B x+ | B
Diagram pada sel galvani/volta dengan elektroda tidak padat:
Reaksi sel : A + Bx+à A y+ + B (elekroda inert, E: Pt, Au, Cl)
Diagram sel : E | A | A y+ || B x+ | B | E
Potensial Elektroda
Pada sel volta yang tersusun dari Pada sel volta yang tersusun dari elektroda Zn dan Cu, ternyata elektroda Zn mengalami oksidasi. Hal ini menunjukkan bahwa logam Zn lebih cenderung mengalami oksidasi dibandi kan logam Cu. Untuk membandingkan kecenderungan logam-logam mengalami oksidasi digunakan elektroda hydrogen sebagai pembanding yang potensial elektrodanya adalah 0 volt. Potensial sel yang dihasilkan oleh elektroda logam dengan elektroda hidrogen pada kondisi standar, yaitu pada suhu 25°C, tekanan gas 1 atmosfer dan konsentrasi ion-ion 1M disebut potensial elektroda standar logam tersebut dan diberi lambang E°.
Potensial elektrode berkaitan dengan reaksi redoks sehingga ada dua jenis potensial elektrode, yaitu potensial reduksi dan potensial oksidasi . potensial oksidasi merupakan nilai yang sama dengan potensial reduksi dengan tanda berlawanan.
E° oksidasi = – E° reduksi
Contoh :
Reaksi reduksi : Zn2+ + 2e → Zn E° = -0,76 volt
Reaksi oksidasi : Zn→ Zn2+ + 2e E° = +0,76 volt
Potensial Sel Standar (Eo sel)
Potensial sel standar (Eo sel) adalah beda potensial listrik antara anoda dan katoda pada sel galvani atau sel volta yang diukur dalam keadaan standar dan tidak dipengaruhi oleh koefisien reaksi.
Potensial sel standar dapat dihitung sebagai berikut:
Eo sel= Eo katoda – Eo anoda
Nilai potensial sel standar menunjukkan:
- Tegangan yang dihasilkan sel
- Jika nilai Eo sel > 0, maka reaksi sel spontan (berlangsung)
- Jika nilai Eo sel ≤ 0, maka reaksi sel tidak spontan (tidak berlangsung). Dapat terjadi karena penempatan anoda dan katoda tidak mengacu pada deret volta.
Potensial Elektroda Standar (Eo )
Potensial elektroda standar adalah ukuran besarnya kecenderungan suatu unsur untuk melepaskan atau mempertahankan elektron yang diukur dalam keadaan standar. Nilai potensial elektroda mengacu pada deret volta dan dikaitkan dengan reaksi reduksi sehingga nilainya sebagai berikut:
Eo= Eoreduksi -Eo oksidasi
Katoda merupakan tempat terjadi reaksi reduksi sehingga mempunyai E° lebih besar, sedangkan anoda merupakan tempat terjadi reaksi oksidasi sehingga mempunyai harga E° lebih kecil.
Potensial sel dapat digunakan untuk memperkirakan spontan tidaknya suatu reaksi redoks. Reaksi redoks berlangsung spontan bila Eosel > 0 (positif) dan tidak spontan bila Eosel < 0 (negatif).

Deret Volta
Pada Deret Volta, unsur logam dengan potensial elektrode lebih negatif ditempatkan di bagian kiri, sedangkan unsur dengan potensial elektrode yang lebih positif ditempatkan di bagian kanan.
Li ; K ; Ba ; Ca ; Na ; Mg ; Al ; Mn ; Zn ; Fe ; Ni ; Sn ; Pb ; (H) ; Cu ; Hg ; Ag ; Pt ; Au
Makin ke kanan : mudah direduksi dan sukar di oksidasi
Makin ke kiri : mudah dioksidasi semakin aktif dan sukar direduksi
Semakin ke kiri kedudukan suatu logam dalam deret tersebut, maka
- Logam semakin reaktif (semakin mudah melepas elektron)
- Logam merupakan reduktor yang semakin kuat (semakin mudah mengalami oksidasi)
Sebaliknya, semakin ke kanan kedudukan suatu logam dalam deret tersebut, maka
- Logam semakin kurang reaktif (semakin sulit melepas elektron)
- Logam merupakan oksidator yang semakin kuat (semakin mudah mengalami reduksi)
Contoh Soal:
Diketahui Potensial elektrode perak tembaga sbb:
Ag+ + e → Ag E0 = + 0,80 V
Cu2+ + 2 e → Cu E0 = + 0,34 V
Carilah :
- Diagram sel
- Harga potensial sel
- Reaksi selnya