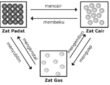
Dalam kehidupan sehari-hari, kita menemukan berbagai jenis zat yang partikelnya berupa molekul dan berbeda fasa. Dalam fasa gas, pada suhu tinggi dan tekanan yang relatif rendah (jauh di atas titik didihnya), molekul-molekul benar-benar berdiri sendiri, tidak ada gaya tarik antarmolekul. Akan tetapi, pada suhu yang relatif rendah dan tekanan yang relatif tinggi, yaitu mendekati titik embunnya, terdapat suatu gaya tarik-menarik antarmolekul. Gaya tarik menarik antar molekul itulah yang memungkinkan suatu gas dapat mengembun (James E. Brady, 1990).
Molekul-molekul dalam zat cair atau dalam zat padat diikat oleh gaya tarikmenarik antar molekul. Oleh karena itu, untuk mencairkan suatu zat padat atau untuk menguapkan suatu zat cair diperlukan energi untuk mengatasi gaya tarik-menarik antar molekul. Makin kuat gaya tarik antar molekul, makin banyak energi yang diperlukan untuk mengatasinya, maka semakin tinggi titik cair atau titik didih. Terdapat lima jenis interaksi antar molekul, yang disusun berdasarkan kekuatan, dari yang terlemah hingga yang terkuat, yaitu Gaya London atau Gaya Dispersi, Interaksi Dipol Terimbas (Dipol Terinduksi), Interaksi Dipol-Dipol, Interaksi Ion-Dipol, Ikatan Hidrogen,
Gaya antar molekul ini memiliki sifat tarik menarik dan juga tolak-menolak antar molekul. Ketika dua molekulnya berdekatan, gaya tolak antara muatan yang sama akan timbul dan semakin tinggi energi tolaknya. Oleh karena itu akan dibutuhkan energi yang lebih tinggi pula untuk memampatkan suatu molekul. Penelitian gaya antar molekul bermula dari pengamatan makroskopik yang menunjukkan adanya aksi gaya-gaya pada tingkat molekul atau mikroskopik. Pengamatan ini meliputi sikap termodinamik gas non-ideal yang dicerminkan oleh koefisien virial, tekanan uap. viskositas, tegangan permukaan, dan data adsorpsi.
Pengertian gaya Antar Molekul
- Dalam kehidupan sehari-hari, kita menemukan berbagai jenis zat yang partikelnya berupa molekul dan berbeda fasa. Dalam fasa gas, pada suhu tinggi dan tekanan yang relatif rendah (jauh di atas titik didihnya), molekul-molekul benar-benar berdiri sendiri, tidak ada gaya tarik antarmolekul.
- Akan tetapi, pada suhu yang relatif rendah dan tekanan yang relatif tinggi, yaitu mendekati titik embunnya, terdapat suatu gaya tarik-menarik antarmolekul. Gaya tarik menarik antar molekul itulah yang memungkinkan suatu gas dapat mengembun (James E. Brady, 1990).
- Molekul-molekul dalam zat cair atau dalam zat padat diikat oleh gaya tarikmenarik antar molekul. Oleh karena itu, untuk mencairkan suatu zat padat atau untuk menguapkan suatu zat cair diperlukan energi untuk mengatasi gaya tarik-menarik antar molekul.
- Gaya antar molekul adalah gaya tarik-menarik antar molekul yang saling berdekatan. Gaya antar molekul berbeda dengan ikatan kimia. Ikatan kimia, seperti ikatan ionik, kovalen, dan logam, semuanya adalah ikatan antar atom dalam membentuk molekul. Sedangkan gaya antar molekul adalah gaya tarik antar molekul.
- Makin kuat gaya tarik antar molekul, makin banyak energi yang diperlukan untuk mengatasinya, maka semakin tinggi titik cair atau titik didih.
Dipol
Dipol adalah singkatan dari di polar, yang artinya dua kutub. Senyawa yang memiliki dipol adalah senyawa yang memiliki kutub positif (δ+) di satu sisi, dan kutub negatif (δ–) di sisi yang lain. Senyawa yang memiliki dipol biasa disebut sebagai senyawa polar. Senyawa polar terbentuk melalui ikatan kovalen polar. Perlu diperhatikan bahwa dipol berbeda dengan ion. Kekuatan listrik yang dimiliki dipol lebih lemah dibanding kekuatan listrik ion. Kita pasti ingat, bahwa ion terdapat pada senyawa ionik, dimana molekul terbagi menjadi dua , yaitu ion positif/kation (+) dan ion negatif/anion (-).
Untuk memahami perbedaan antara ion dan dipol, mari kita perhatikan gambar berikut:

Dari gambar di atas dapat dilihat bahwa pada senyawa ion, molekul terbagi (bisa juga dikatakan terbelah) menjadi dua bagian. Jadi ion positif dan ion negatif sebenarnya terpisah. Mereka bersatu hanya karena adanya gaya tarik-menarik antar ion positif dan negatif (gaya coulomb). Pada senyawa polar, tidak terjadi pemisahan. Molekul merupakan satu kesatuan. Hanya saja pada satu sisi/tepi terdapat kutub positif (δ+) dan di sisi/tepi yang lain terdapat kutub negatif (δ–). Untuk senyawa non polar, sama sekali tidak ada muatan listrik yang terkandung.