- Teori Valence Shell Electron Pair of Repulsion (VSEPR) dan Teori Domain Elektron.
Teori VSEPR adalah teori yang menggambarkan bentuk molekul berdasarkan kepada tolakan pasangan elektron disekitar atom pusat. Teori tolakan pasangan elektron ini dikenal dengan istilah VSEPR (Valence Shell Elektron Pair of Repulsion).
Bentuk molekul didasarkan kepada jumlah elektron yang saling tolak-menolak disekitar atom pusat yang akan menempati tempat sejauh munkin untuk meminimumkan tolakan.
Teori VSEPR merupakan penjabaran sederahana dari rumus Lewis yang berguna untuk memprediksikan bentuk molekul poliatom berdasarkanstru ktur Lewis-nya. Teori VSEPR pertama kali dikembangkan oleh NevilSidgwick dan Herbet Powel pada tahun 1940, dan dikembangkan lebihlanjut oleh Ronald Gillespie dan Ronald Nyholm.
Ide dasar teori VSEPR adalah adanya tolakan antara pasangan elektron sehingga pasangan elektron tersebut akan menempatkan diri pada posisi sejauh mungkin dari pasangan elektron lainnya. Posisi pasangan elektron satu dengan yang lain yang semakin berjauhan akan menyebabkan tolakan antar mereka menjadi semakin kecil. Pada posisi yang paling jauh yang dapat dicapai, tolakan antar pasangan elektron menjadi minimal. Tolakan antar pasangan elektron terjadi antara pasangan elektron bebas yang terlokalisasi pada atom pusat dan elektron ikat secara ikatan koordinasi. Teori VSEPR mengasumsikan bahwa masing- masing molekul akan mencapai geometri tertentu sehingga tolakan pasangan antarelektron di kulit valensi menjadi minimal.
Teori Domain Elektron
Menurut Ralph H. Petrucci (1985), teori Domain Elektron merupakan penyempurnaan dari teori VSEPR. Teori ini adalah suatu cara meramalkan bentuk molekul berdasarkan tolak menolak elektron-elektron pada kulit luar atom pusat. Domain elektron berarti kedudukan elektron atau daerah keberadaan elektron. Jumlah domain elektron ditentukan sebagai berikut: a. Setiap elektron ikatan (apakah ikatan tunggal, rangkap atau rangkap tiga) merupakan 1 domain. b. Setiap pasangan elektron bebas merupakan 1 domain.
Contoh :
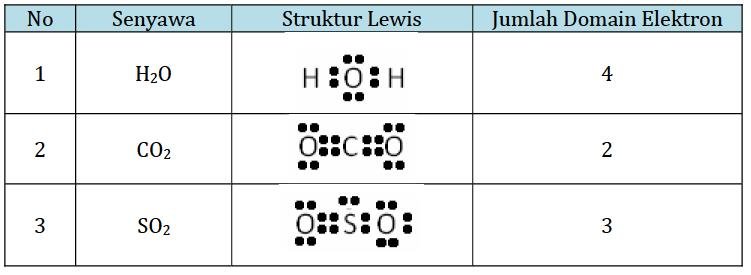
Tentukan domain elektron atom pusat pada beberapa senyawa : H2O, CO2 dan SO2!
Pembahasan :
- Gambarkan struktur lewis masing-masing senyawa
- Setiap satu elektron ikatan (tunggal, rangkap dua maupun rangkap tiga merupakan satu domain
- Setiap pasangan elektron bebas merupakan satu domain Sehingga jumlah domainnya dapat dilihat pada tabel berikut.
Contoh Penentuan Domain Elektron
Penjelasan :
- Pada struktur lewis H2O atom pusat O dikelilingi oleh 4 PEI sehingga jumlah domain elektron = 4
- Pada struktur lewis CO2 atom pusat C dikelilingi oleh 2 ikatan rangkap, sehingga domain elektron = 2 3. Pada struktur lewis SO2 atom pusat S dikelilingi oleh dua ikatan rangkap, ikatan tunggal dan 1 PEB, sehingga jumlah domain elektron = 3
Teori domain elektron mempunyai prinsip-prinsip dasar sebagai berikut:
- Antar domain elektron pada kulit luar atom pusat saling tolak-menolak sehingga domain elektron akan mengatur diri (mengambil formasi) sedemikian rupa, sehingga tolak-menolak di antaranya menjadi minimum.
- Urutan kekuatan tolak-menolak di antara domain elektron adalah: Tolakan antar domain elektron bebas > tolakan antara domain elektron bebas dengan domain elektron ikatan > tolakan antara domain elektron ikatan.
- Bentuk molekul hanya ditentukan oleh pasangan elektron ikatan.
- Rumus/Tipe Molekul
Rumusan tipe molekul dapat ditulis dengan lambang AXnEm (jumlah pasangan elektron), pasangan elektron ikatan (PEI) dan pasangan elektron bebas (PEB)

dimana :
A : Atom pusat
X : Jumlah pasangan elektron ikatan (PEI)
E : jumlah pasangan elektron bebas (PEB)
Catatan:
- ikatan rangkap dua atau rangkap tiga dihitung satu pasang electron ikatan
- tolakan antara PEB-PEB> PEB-PEI>PEI-PEI
- PEI menentukan bentuk molekul,PEB mempengaruhi besar sudaut ikatan
Langkah-langkah memprediksi bentuk molekul dengan teori VSEPR
- Tentukan struktur lewis dari rumus molekul
- Tentukan jumlah PEB dan PEI atom pusat
- Tentukan tipe/rumus molekulnya
- Gambar bentuk molekul dan beri nama sesuai dengan jumlah PEI dan PEB
Contoh :
- Senyawa metana, CH4
Struktur lewisnya dapat digambarkan sebagai berikut :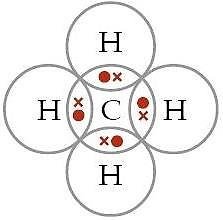
Dari struktur lewisnya, bahwa atom pusat, C memiliki empat pasangan elektron ikatan (PEI) dan tidak memiliki pasangan elektron bebas (PEB), sehingga tipe molekulnya adalah AX4.
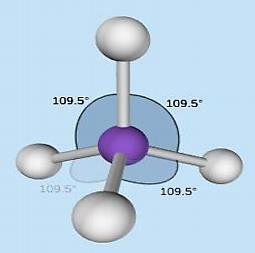
Pasangan elektron ikatan akan menempati posisi dimana tolakan sekecil mungkin, sehingga posisi PEI antara satu dengan yang lain menjadi sama jaraknya dan menghasilkan sudut antara H – C – H yang sama besarnya, sehingga berdasarkan rumus/tipe molekulnya, CH4 memiliki bentuk tetrahedral seperti tampak pada gambar berikut.
Bentuk molekul CH4
- Senyawa amonia, NH3
Struktur lewis NH3 adalah sebagai berikut :
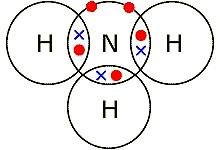
Pembahasan :
Atom pusat adalah N mempunyai elektron valensi 5 Pasangan Eekton ikatan (X) = 3 Pasangan Elektron Bebas E = (5-3)/2 = 1 Bentuk molekul AX3E bentuk molekulnya piramida segitiga
Dengan menggunakan teori VSEPR maka kita dapat meramalkan bentuk geometri suatu molekul, seperti terlihat pada tabel berikut.
Hubungan antara jumlah PEI, PEB, tipe molekul dan bentuk molekul

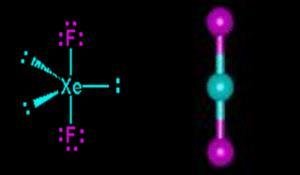
Dalam kesempatan ini maka akan di contohkan menentukan bentuk geometri molekul XeF2. Pertama kita harus mementukan struktur lewis masing-masing molekul. Xe memiliki jumlah elektron valensi 8 sedangkan F elektron valensinya adalah 7.
Struktur Lewis XeF2 seperti gambar di bawah, dua elektron Xe masing-masing diapakai untuk berikatan secara kovalen dengan 2 atom F sehingga meninggalkan 3 pasangan elektron bebas pada atom pusat Xe.
Lihat gambar diatas XeF2 memiliki 2 pasangan elektron ikatan (PEI) dan 3 pasangan elektron bebas (PEB) 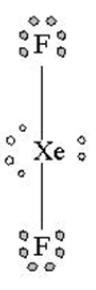
Jadi total ada 5 pasangan elektron yang terdapat pada XeF2, hal ini menandakan bahwa geometri molekul atau kerangka dasar molekul XeF2 adalah trigonal bipiramid. Karena terdapat 3 PEB maka PEB ini masing masing akan menempati posisi ekuatorial pada kerangka trigonal bipiramid, sedangkan PEI akan menempati posisi aksial yaitu pada bagian atas dan bawah. Posisi inilah posisi yang stabil apabila terdapat atom dengan 2 PET dan 3 PEB sehingga menghasilkan bentuk molekul linear. Jadi bentul molekul XeF2 adalah linier.(lihat gambar dibawah).