Kebanyakan senyawa tidak dapat disintesis langsung dari unsur-unsurnya. Dalam beberapa kasus, reaksi berlangsung terlalu lambat, atau terjadi reaki samping menghasilkan zat-zat selain senyawa yang diharapkan. Dalam kasus-kasus ini ∆Hfo dapat ditentukan dengan cara pendekatan tidak langsung, yang didasarkan pada hukum penjumlahan kalor (Hukum Hess).
Sebagai contoh penentuan perubahan entalpi pembentukan standar (ΔHf0) CO.
Reaksi pembentukan CO adalah :
C(s) + ½ O2(g) → CO(g)
Reaksi pembakaran karbon tidak mungkin hanya menghasilkan gas CO saja tanpa disertai terbentuknya gas CO2. Jadi, bila dilakukan pengukuran perubahan entalpi dari reaksi tersebut yang terukur tidak hanya reaksi pembentukan gas CO saja, tetapi juga terukur pula perubahan entalpi dari reaksi :
C(s) + O2(g) → CO2(g)
Untuk mengatasi persoalan tersebut Henry Germain Hess (1840) melakukan serangkaian percobaan dan diperoleh kesimpulan bahwa perubahan entalpi suatu reaksi merupakan fungsi keadaan. Artinya, bahwa perubahan entalpi suatu reaksi hanya tergantung pada keadaan awal (zat-zat pereaksi) dan keadaan akhir (zat-zat hasil reaksi) dari suatu reaksi dan tidak bergantung pada jalannya reaksi, terlepas apakah reaksi berlangsung dalam satu tahap atau beberapa tahap. Bila keadaan awal dan akhirnya sama, maka harga perubahan entalpinya sama. Pernyataan ini dikenal sebagai Hukum Hess.
Contoh:
Reaksi pembakaran karbon menjadi gas CO2 dapat berlangsung dalam dua tahap, yaitu:
Tahap 1 : C(s) + ½ O2(g) → CO(g) ∆H = a kJ
Tahap 2 : CO(g) + ½ O2(g) → CO2(g) ∆H = b kJ
Dengan demikian, perubahan entalpi secara keseluruhan apabila reaksi dilakukan dalam satu tahap, tanpa melewati gas CO adalah:
Tahap langsung : C(s) + O2(g) → CO2(g) ∆H = (a+b)
Dari dua kemungkinan tersebut, penentuan perubahan entalpi pembentukan gas CO dapat dilakukan dengan cara:
1.Menentukan secara kalorimetri perubahan entalpi dari reaksi tahap langsung dan didapat:
C(s) + O2(g) → CO2(g) ∆H =-394 kJ
Menentukan secara kalorimetri perubahan entalpi pada tahap 2, dan di dapat:
CO(g) + ½ O2(g) → CO2(g) ∆H = -283 kJ
Dari dua reaksi tersebut, didapat perubahan entalpi untuk reaksi pada tahap 1 adalah:
-394 kJ = a + (-283) kJ
a = (-394) – (-283) kJ
a = -111 kJ
Sehingga: C(s) + O2(g) → CO2(g) ∆H = -111 kJ
Secara analitis, dapat ditulis dengan cara:
C(s) + O2(g) → CO2(g) ∆H = -394 kJ
CO(g) + ½ O2(g) → CO2(g) ∆H = -283 kJ +
C(s) + ½ O2(g) → CO(g) ∆H = – 111kJ
Rute reaksi tersebut digambarkan oleh Hess dengan siklus energy yang dikenal dengan siklus Hess.

Berdasarkan siklus Hess tersebut diketahui bahwa keadaan awal (pereaksi) adalah C(grafit) + O2(g) dan hasil reaksinya adalah 2CO2(g), ΔH1 = ΔH2 + ΔH3
Jika digambarkan tahap-tahap perubahan energinya, akan diperoleh suatu diagram entalpi (tingkat energi) sebagai berikut.
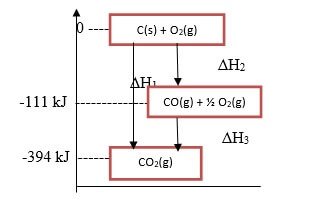
Ada tiga cara yang dapat kita pakai untuk mencari ΔHreaksi dengan hukum Hess ini, yaitu cara persamaan reaksi, cara diagram, dan siklus.
1.Persamaan Reaksi
Cara ini dilakukan dengan menyusun serangkaian persamaan kimia (yang berhubungan dengan reaksi beberapa tahap sedemikian rupa sehingga, ketika dijumlahkan, semua spesi akan hilang kecuali reaktan dan produk yang diperlukan untuk keseluruhan reaksi. Jika suatu persamaan reaksi dikalikan atau dibagi dengan suatu angka, perubahan entalpinya harus dikali/dibagi pula. Jika persamaan itu dibalik, maka tanda perubahan entalpi harus dibalik pula ((+) menjadi (–) atau sebaliknya). Jadi pada pemakaian cara ini memerlukan ketelitian dalam menentukan apakah suatu reaksi tetap, dibalik, atau dikalikan karena akan mempengaruhi hasilnya.
2.Diagram
Seperti bunyi hukum Hess, perhitungan dengan cara diagram adalah dengan memperhatikan keadaan awal, keadaan akhir, dan tanda panah reaksi (atas atau bawah).
3.Siklus
Cara siklus mirip sama cara diagram, hanya bentuknya lebih fleksibel