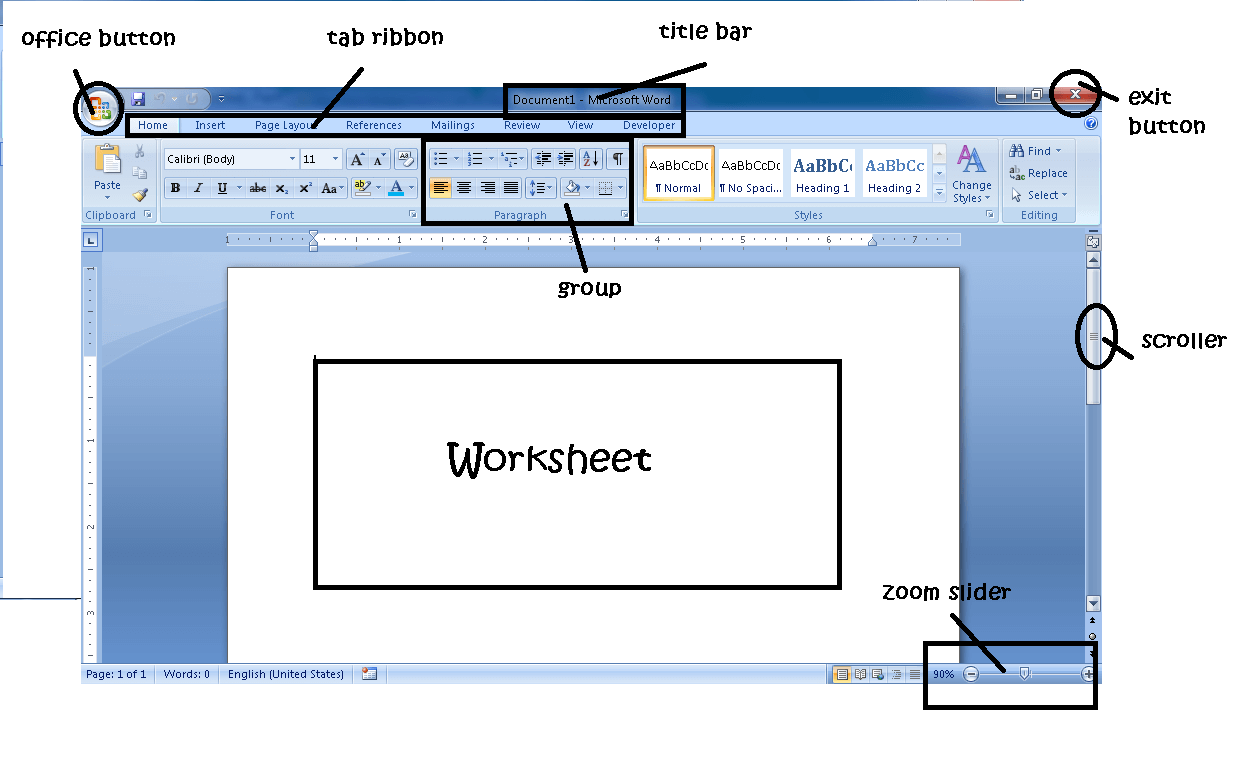
Seorang ahli dari Inggris bernama Michael Faraday mengalirkan arus listrik ke dalam larutan elektrolit dan ternyata terjadi suatu reaksi kimia. Proses penggunaan arus listrik untuk menghasilkan reaksi kimia disebut sel elektrolisis.
Arus listrik ini bisa berasal dari sel volta. Untuk memahami bagaimana reaksi kimia yang terjadi dalam sel elektrolisis,
maka perlu diingat ketentuan-ketentuan reaksi elektrolisis. Dalam setiap ketentuan reaksi elektrolisis terjadi persaingan antarspesi (ion atau molekul) untuk mengalami reaksi reduksi atau reaksi oksidasi. Setiap zat yang mempunyai kemampuan reduksi besar akan mengalami reaksi reduksi dan setiap zat yang mempunyai kemampuan oksidasi besar akan mengalami reaksi oksidasi.
A. Sel Elektrolisis Bentuk Lelehan/Cairan/Liquid
Sel bentuk ini hanya berlaku untuk senyawa ionik dengan tidak ada zat
pelarut (tidak ada H2O). Hanya ada kation dan anion.
Katode : Kation langsung direduksi
X+(aq) + e– ⎯>X(s)
Anode : Anion langsung dioksidasi
Y(s) -> Y+(aq) + e–
Kation golongan utama atau golongan transisi langsung direduksi.
B. Sel Bentuk Larutan dengan Elektrode Tidak Bereaksi (Inert/Tidak Aktif)
Dalam sel bentuk ini tidak ada pengaruh elektrode, hanya di samping kation dan anion diperhitungkan juga adanya zat pelarut (adanya air). Elektrode yang digunakan adalah platina (Pt) dan karbon (C).
1. Ketentuan di Katode
Di katode terjadi reaksi reduksi, untuk ini terjadi persaingan antara kation atau air. Untuk kation yang mempunyai potensial reduksi lebih besar dibanding air, berarti kation tersebut direduksi. Sedangkan jika potensial reduksi kation lebih kecil dibanding air, maka H2O yang berhak direduksi. Untuk itu kita harus mengetahui posisi H2O dalam deret volta. Posisi H2O dalam deret volta terdapat di antara Mn dan Zn.
Ternyata kebanyakan logam yang berada di sebelah kiri H2O adalah logam-logam golongan utama (golongan A), kecuali logam Mn. Sedangkan logam yang berada di sebelah kanan H2O adalah logam-logam golongan transisi (golongan B), kecuali H.
Secara sederhana:

2. Ketentuan di Anode
Di anode terjadi reaksi oksidasi, untuk ini terjadi persaingan antara anion dan air. Idealnya untuk anion dengan potensial reduksi kecil atau dengan potensial oksidasi besar, maka anion tersebut dioksidasi. Sedangkan untuk anion dengan potensial reduksi besar atau potensial oksidasi kecil, maka H2O yang dioksidasi. Hanya saja kebanyakan urutan potensial reduksi yang mudah untuk diingat adalah kation bukan anion. Untuk memudahkan mengingat, kita lihat ada 2 golongan anion, yaitu anion yang mengandung O, seperti SO, NO3, C1O4– maka yang dioksidasi
adalah H2O. Ini disebabkan karena anion tersebut sukar dioksidasi (Ingat,reaksi oksidasi dexigan oksigen). Sedangkan anion yang tidak mengandung O, seperti Cl–, Br–, I–, dan OH– maka yang dioksidasi adalah anion tersebut.
Secara sederhana:

Demikianlah pembahasan mengenai sel elektrolisis.