Apa yang ada di pikiran kalian ketika disebutkan kata asam ?
Mungkin yang ada di pikiran kalian seperti gambar di bawah ini :


Asam identik dengan rasa masam/kecut.
Lalu, bagaimana dengan basa? Apa yang ada dipikiran kalian ketika mendengar kata basa? Adakah yang memikirkan benda – benda di bawah ini :

Tanpa kita sadari, asam dan basa adalah zat kimia yang banyak ditemukan dalam kehidupan kita sehari-hari, bahkan dalam tubuh kitapun dapat menemukannya yaitu asam klorida yang ada di dalam lambung. Saat cairan lambung meningkat, biasanya kita akan mengonsumsi obat maag yang ternyata di dalamnya terdapat senyawa basa yang berfungsi menetralkan asam lambung. Karena manfaatnya yang besar dalam kehidupan sehari-hari dan industri, maka pengetahuan mengenai asam basa sangat perlu dipelajari. Materi asam basa dapat dipelajari di kelas XI SMA. Berikut akan kami uraian ringkasan materi dan latihan soal tentang larutan asam basa.
TEORI ASAM BASA
- Teori Arrhenius
Asam : zat yang jika dilarutkan dalam air, menghasilkan ion H+
Basa : zat yang jika dilarutkan dalam air, menghasilkan ion OH-
- Teori Bronsted dan Lowry
Asam : donor proton (H+)
Basa : akseptor/penerima proton(H+)

3. Teori Lewis
Asam : akseptor (penerima) elektron
Basa : donor elektron
Menghitung pH larutan

- Menentukan nilai pH berdasarkan beberapa indikator
Seorang siswa melakukan pengujian pH air limbah dengan berbagai indikator. Data yang diperoleh adalah sebagai berikut :
| Indikator | Trayek | Warna air limbah | |
| pH | Perubahan warna | ||
| Metil merah | 4,0- 6,2 | Merah – kuning | Kuning |
| Bromtimol biru | 6,0 – 7,6 | Kuning – biru | Biru |
| phenolphtalein | 8,3 – 10,0 | Tak berwarna – merah muda | Tak berwarna |
Maka pH air limbah adalah :
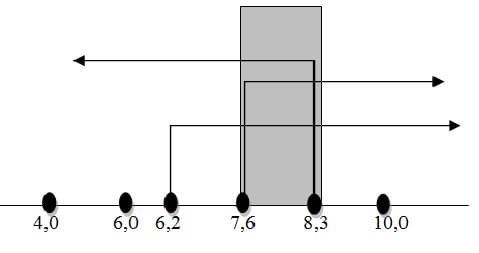
Jadi, larutan tersebut mempunyai 7,6 ≤ pH ≤ 8,3
Untuk lebih memahami mengenai materi ini, anda dapat berlatih soal- soal yang ada di link download di bawah ini :