A. Unsur dan Molekul
Apakah kalian ingat tabel ini ?
Tabel ini terdiri dari berbagai unsur kimia yang lebih dahulu perlu kalian kenali. Tabel ini juga memberikan contoh cara menuliskan lambang unsur dengan baik. Saat mempelajari IPA di SMP, alah satu materi yang dipelajari adalah mengenai zat tunggal dan campuran. Zat tunggal terdiri atas unsur dan senyawa, sedangkan campuran terdiri atas larutan, koloid, dan suspensi. Untuk mengingat kembali materi tersebut, simak diagram di bawah ini :

Unsur merupakan zat tunggal yang tidak dapat diuraikan menjadi zat lainnya melalui reaksi kimia. Setiap unsur disusun dari gabungan atom sejenis. Sementara atom adalah unit terkecil
dari suatu zat yang memiliki sifat kimia suatu unsur. Gabungan atom sejenis akan membentuk molekul unsur misalnya gas Oksigen (O2), ozon (O3), gas hidrogen (H2), gas klorin (Cl2), dan gas nitrogen (N2). Adapun gabungan atom yang berbeda akan menghasilkan molekul senyawa antara lain gas karbon dioksida (CO2), air (H2O), dan glukosa (C6H12O6).
B. Persamaan Reaksi Kimia
Reaksi kimia merupakan proses perubahan yang terjadi bila satu senyawa berubah atau bereaksi dengan senyawa atau unsur lain, menghasilkan senyawa atau unsur yang baru. Secara molekuler proses kimia selalu disimbolkan dengan persamaan reaksi. Zat-zat yang terlibat dalam reaksi kimia: Pereaksi/reaktan adalah zat-zat yang mengalami perubahan, Zat hasil reaksi/produk adalah zat-zat hasil perubahan dalam reaksi kimia. Anak panah dibaca yang artinya “membentuk” atau “bereaksi menjadi”. Wujud atau keadaan zat-zat pereaksi dan hasil reaksi ada empat macam, yaitu gas (g), cairan (liquid atau l), zat padat (solid atau s) dan larutan (aqueous atau aq). Bilangan yang mendahului rumus kimia zat-zat dalam persamaan reaksi disebut koefisien reaksi. Koefisien reaksi diberikan untuk menyetarakan atom-atom sebelum dan sesudah reaksi. Selain untuk menyetarakan persamaan reaksi, koefisien reaksi menyatakan perbandingan paling sederhana dari partikel zat yang terlibat dalam reaksi. Misalnya, reaksi antara gas hidrogen dengan gas oksigen membentuk air sebagai berikut:
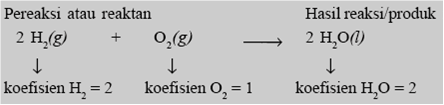
Berdasarkan persamaan reaksi di atas, berarti 2 molekul hidrogen bereaksi dengan 1 molekul oksigen membentuk 2 molekul H2O. Oleh karena itu sebaiknya dihindari koefisien pecahan karena dapat memberi pengertian seolaholah partikel materi (atom atau molekul) dapat dipecah.
Penulisan persamaan reaksi dapat dilakukan dalam dua langkah sebagai berikut.
- Menuliskan rumus kimia zat-zat pereaksi dan produk, lengkap dengan keterangan tentang wujudnya.
- Penyetaraan, yaitu memberi koefisien yang sesuai, sehingga jumlah atom ruas kiri sama dengan jumlah atom ruas kanan.
- Penyetaraan Persamaan Reaksi
Penyetaraan reaksi kimia dilakukan dengan langkah berikut :
- Tetapkan koefisien sementara zat-zat yang ada pada reaksi dengan huruf.
- Pilihlah satu rumus kimia yang paling rumit, tetapkan koefisiennya sama dengan 1.
- Setarakan dahulu unsur yang terkait langsung dengan zat yang tadi diberi koefisien 1.
- Setarakan unsur lainnya. Biasanya akan membantu jika atom O disetarakan paling akhir.
Contoh Soal:
Tuliskan persamaan reaksi kimia setara (beserta fasa reaktan dan produk) dari reaksi logam aluminium dengan larutan asam klorida membentuk larutan aluminium klorida dan gas hidrogen.
