Sel volta dibagi menjadi tiga bagian, yaitu Sel Volta Primer, Sel Volta Sekunder, Sel Bahan Bakar.
1.Sel Volta Primer
Sel primer adalah sel yang dibentuk dari katode dan anode yang langsung setimbang ketika menghasilkan arus. Beberapa sel Volta primer komersial adalah :
a.Baterai Kering (Sel Leclanche)
 Baterai kering disebut juga sel Leclanche. Baterai kering ini mendapatkan hak paten penemuan di tahun 1866 oleh George Lechlanche. Sel Leclanche tergolong sel primer yang biasa digunakan untuk pesawat radio, senter, remote control, dsb.
Baterai kering disebut juga sel Leclanche. Baterai kering ini mendapatkan hak paten penemuan di tahun 1866 oleh George Lechlanche. Sel Leclanche tergolong sel primer yang biasa digunakan untuk pesawat radio, senter, remote control, dsb.
Sel Leclanche ini terdiri atas suatu silinder zink berisi pasta dari campuran batu kawi, (MnO2), salmiak (NH4Cl), karbon (C), dan sedikit air. Dengan adanya air jadi baterai kering ini tidak 100% kering.Penggunaan logam seng adalah sebagai anoda sedangkan katoda digunakan elektrode inert, yaitu grafit, yang dicelupkan ditengah-tengah pasta. Pasta ini bertujuan sebagai oksidator. Seng tersebut akan dioksidasi sesuai dengan persamaan reaksi di bawah ini:
Zn(s) → Zn2+(aq) + 2e– (anoda)
Sedangkan katoda terdiri atas campuran dari MnO2 dan NH4Cl. Reaksi yang terjadi dapat ditulis sebagai berikut:
2MnO2(s) + 2NH4+(aq) + 2e– → Mn2O3(s) + 2NH3(aq) + H2O(l) (katoda)
Katoda akan menghasilkan ammonia, ammonia ini akan bereaksi dengan Zn2+ yang dihasilkan di anode. Reaksi tersebut akan membentuk ion yang kompleks [Zn(NH3)4]2+.
Zn2+(aq) + 4NH3(aq) →[Zn(NH3)4]2+(aq)
Baterai kering ini tidak dapat digunakan berulang kali dan memiliki daya tahan yang tidak lama. Dan harganya di pasaran sangatlah murah. Baterai kering ini memiliki potensial sel sebesar 1,5 Volt.
b.Baterai Perak Oksida
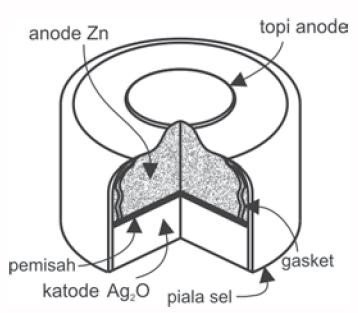 Baterai perak oksida tergolong tipis dan harganya yang relatif lebih mahal dari baterai-baterai yang lainnya. Baterai ini sangat populer digunakan pada jam, kamera, dan kalkulator elektronik.
Baterai perak oksida tergolong tipis dan harganya yang relatif lebih mahal dari baterai-baterai yang lainnya. Baterai ini sangat populer digunakan pada jam, kamera, dan kalkulator elektronik.
Perak oksida (Ag2O) sebagai katoda dan seng sebagai anodanya. Reaksi elektrodenya terjadi dalam elektrolit yang bersifat basa dan mempunyai beda potensial sama seperti pada baterai alkaline sebesar 1,5V. Reaksi yang terjadi adalah:
Zn(s) + 2OH–(aq) → Zn(OH)2(s) + 2e– (anoda)
Ag2O(s) + H2O(l) + 2e– → 2Ag(s) + 2OH–(aq) (katoda)
c. Baterai Litium
Terdiri atas litium sebagai anoda dan MnO2 sebagai oksidator (seperti pada baterai alkaline). Baterai Litium ini dapat menghasilkan arus listrik yang lebih besar dan daya tahannya lebih lama dibandingkan baterai kering yang berukuran sama. Berikut notasi dari baterai Litium:
Anode : Li(s) –> Li+(aq) + e–
Katode : MnO2(s) + Li+ + e- –> MnO2Li(aq) +
Reaksi Sel : Li(s) + MnO2(s) –> MnO2Li(aq)
Li│Li+ (pelarut non-air)│KOH (pasta)│MnO2, Mn(OH)3, C
2. Sel Volta Sekunder
Sel sekunder adalah sel yang dapat diperbarui dengan cara mengembalikan elektrodenya ke kondisi awal.
a. Aki Timbal
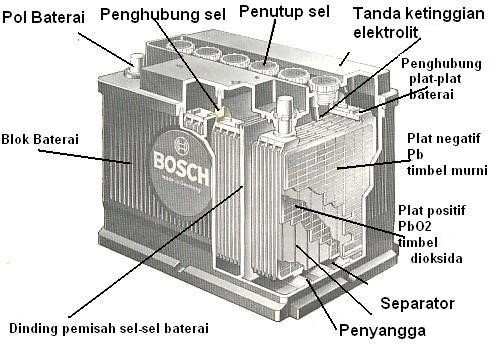 Aki merupakan jenis baterai yang dapat digunakan untuk kendaran bermotor atau automobil. Aki timbal mempunyai tegangan 6V atau 12V, tergantung jumlah sel yang digunakan dalam konstruksi aki timbal tersebut.
Aki merupakan jenis baterai yang dapat digunakan untuk kendaran bermotor atau automobil. Aki timbal mempunyai tegangan 6V atau 12V, tergantung jumlah sel yang digunakan dalam konstruksi aki timbal tersebut.
Aki timbal ini terdiri atas katoda PbO2(timbel(IV) oksida) dan anodanya Pb (timbel=timah hitam). Kedua zat sel ini merupakan zat padat, yang dicelupkan kedalam larutan H2SO4. Reaksi yang terjadi dalam aki adalah:
Pb(s) + SO42-(aq) → PbSO4(s) + 2e– (anoda)
PbO2(s) + 4H+(aq) + SO42-(aq) + 2e– → PbSO4(s) + 2H2O (katoda)
Aki ini dapat diisi ulang dengan mengalirkan lagi arus listrik ke dalamnya. Pengisian aki dilakukan dengan membalik arah aliran elektron pada kedua elektrode. Pada pengosongan aki, anoda (Pb) mengirim elektron ke katoda (PbO2). Sementara itu pada pengisian aki, elektrode timbal dihubungkan dengan kutub negatif sumber arus sehingga Pb2SO4 yang terdapat pada elektrode timbal itu direduksi. Berikut reaksi pengisian aki:
PbSO4(s) + H+(aq) +2e– → Pb(s) + HSO4–(aq) (elektrode Pb sebagai katoda)
PbSO4(s) + 2H2O(l) → PbO2(s) + HSO4–(aq) + 3H+(aq) + 2e– (elektrode PbO2 sebagai anoda).
b. Baterai Nikel Kadmium
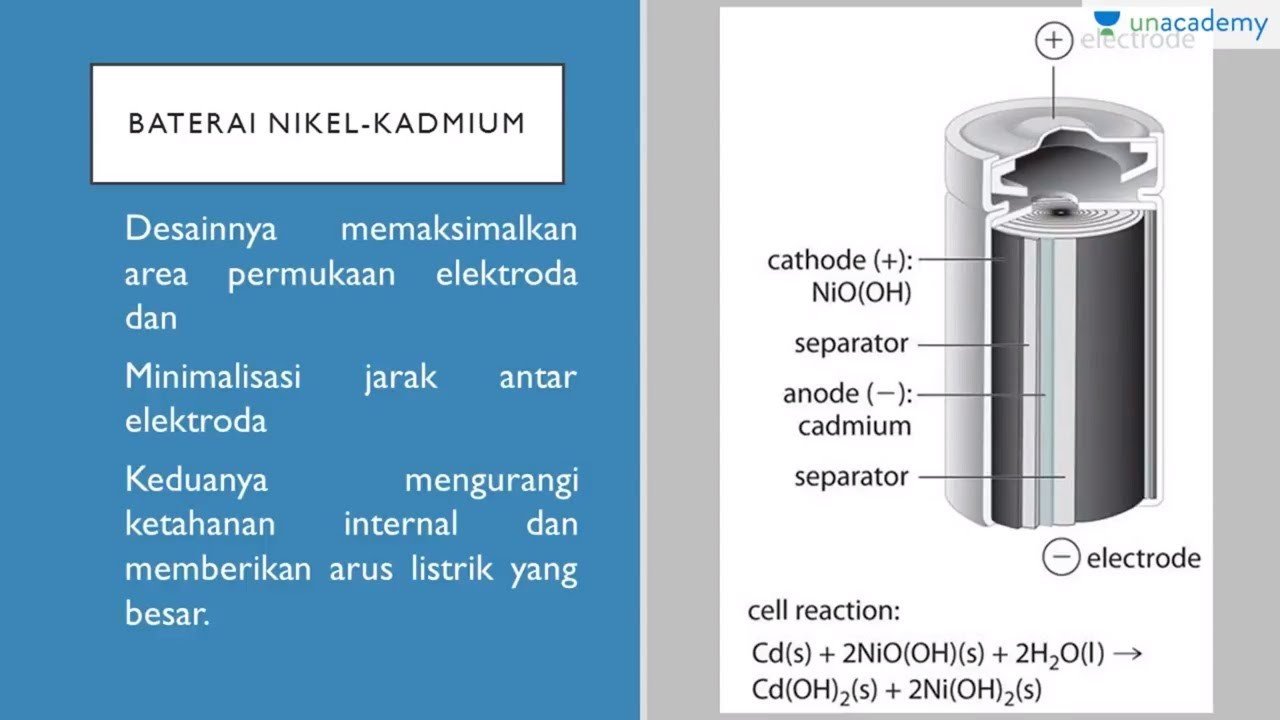 Baterai nikel-kadmium merupakan baterai kering yang dapat diisi ulang. Sel ini biasanya disebut ni-cd atau bateray nickel-cadmium. Baterai nikel-kadmium merupakan zat padat yang melekat pada kedua elektrodenya. Baterai nikel-kadmium memiliki tegangan sekitar 1,4V. Dengan membalik arah aliran elektron, zat-zat tersebut dapat diubah kembali seperti zat semula.
Baterai nikel-kadmium merupakan baterai kering yang dapat diisi ulang. Sel ini biasanya disebut ni-cd atau bateray nickel-cadmium. Baterai nikel-kadmium merupakan zat padat yang melekat pada kedua elektrodenya. Baterai nikel-kadmium memiliki tegangan sekitar 1,4V. Dengan membalik arah aliran elektron, zat-zat tersebut dapat diubah kembali seperti zat semula.
Reaksi yang terjadi pada baterai nikel-kadmium adalah:
Cd(s) + 2OH–(aq) → Cd(OH)2(s) + 2e– (anoda)
NiO2(s) + 2H2O(l) + 2e– → Ni(OH)2(s) + 2OH–(aq) (katoda)
Reaksi keseluruhan adalah:
Cd(s) + NiO2(s) + 2H2O(l) → Cd(OH)2(s) + Ni(OH)2(s)
c. Baterai Ion Litium
 Baterai ion litium menggunakan ion litium sebagai anodenya, bukan logam litium. Oleh karena menggunakan ion litium, maka pada hakekatnya reaksi sel dalam baterai ion litium bukanlah reaksi redoks, melainkan hanya pergerakan ion litium melalui elektrolit dari satu elektrode ke elektrode lainnya.
Baterai ion litium menggunakan ion litium sebagai anodenya, bukan logam litium. Oleh karena menggunakan ion litium, maka pada hakekatnya reaksi sel dalam baterai ion litium bukanlah reaksi redoks, melainkan hanya pergerakan ion litium melalui elektrolit dari satu elektrode ke elektrode lainnya.
Ion litium dapat bergerak(slip) pada daerah antarlapisan atom dalam kristal tertentu. Proses ini disebut interkalasi. Pergerakan ion litium terjadi di antara kristal grafit dan LiCoO2+. Material inilah yang digunakan sebagai elektrode dalam baterai ion litium. Sebagai elektrolit digunakan bahan cair yang biasanya mengandung LiPF6 (mengandung ion Li+ dan PF6–).
Baterai ion litium diproduksi dalam keadaan kosong, dimana tidak ada ion litium di antara atom karbon dalam grafit. Ketika diisi, ion litium dari LiCoO2 akan bergerak melalui elektrolit menuju elektrode grafit.
Reaksi yang terjadi pada saat pengisian awal :
LiCoO2 +C6 –> Li1-xCoO2 + LixC6
(C6 menyatakan grafit, merujuk pada struktur grafit yang berbentuk heksagonal; x-1 menyatakan jumlah ion litium yang berpindah dari LiCoO2 ke C6).
Ketika baterai digunakan (pengosongan), maka ion litium bergerak secara spontan dari grafit ke LiCoO2.
Li1-xCoO2 + LixC6 à Li1-xCoO2 + Li1-x+y + Lix-yC6
Baterai ini menghasilkan potensial sebesar 3,7 Volt, tiga kali lebih besar dibandingkan baterai nicad. Baterai ini banyak digunakan untuk telepon seluler, kamera video, dan laptop.
3. Sel Bahan Bakar
 Sel bahan bakar adalah sel yang menggunakan bahan bakar seperti campuran hidrogen dengan oksigen atau campuran gas alam dengan oksigen. Sel bahan bakar ini biasanya digunakan untuk sumber energi listrik pesawat ulang-alik, pesawat Challenger dan Columbia. Yang berperan sebagai katode adalah gas oksigen dan anodanya gas hidrogen. Masing-masing elektrode dimasukkan kedalam elektrode karbon yang berpori-pori dan masing-masingnya elelktrode digunakan katalis dari serbuk platina.
Sel bahan bakar adalah sel yang menggunakan bahan bakar seperti campuran hidrogen dengan oksigen atau campuran gas alam dengan oksigen. Sel bahan bakar ini biasanya digunakan untuk sumber energi listrik pesawat ulang-alik, pesawat Challenger dan Columbia. Yang berperan sebagai katode adalah gas oksigen dan anodanya gas hidrogen. Masing-masing elektrode dimasukkan kedalam elektrode karbon yang berpori-pori dan masing-masingnya elelktrode digunakan katalis dari serbuk platina.
Katoda: menghasilkan ion OH–
O2(g) + 2H2O(l) + 4e– → 4OH–(aq)
Anoda: dari katode bereaksi dengan gas H2
2H2(g) + 4OH–(aq) → 4H2O(l) + 2e–
Reaksi selnya adalah: O2(g) + 2H2(g) → 2H2O(l)