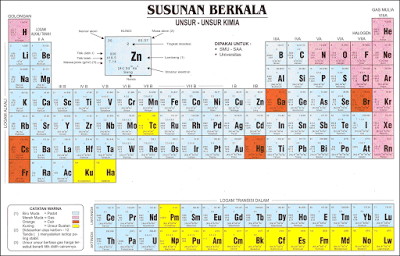
Sistem Periodik Unsur atau Tabel Periodik Unsur berisi deretan unsur-unsur yang berjumlah 118 unsur. Unsur – unsur tersebut disusun dalam baris dan kolom yang disebut peiode dan golongan. Lajur vertikal disebut Periode, sedangkan lajur horisontal disebut Golongan. Sebelum disusun SPU seperti yang sekarang ini kita pakai, para ahli telah mencoba mengelompokkan unsur – unsur yang dimulai dari Lavoisier sampai Sistem Periodik Modern yang sekarang kita pakai.
- Pengelompokkan unsur menurut Lavoisier
Pengelompokan unsur oleh Lavoisier (saat itu baru 20 jenis unsur) didasarkan pada kemiripan sifat fisik, unsur-unsur dikelompokkan dalam logam dan bukan logam.
| Unsur logam | Bukan logam |
| besi, emas, dan tembaga | karbon, belerang, oksigen dan nitrogen. |
- Pengelompokkan unsur menurut Dobereiner (Triade Dobereiner)
Pada 1829 telah dikenal 40 jenis unsur. Dasar pengelompokkan unsur menurut Dobereiner adalah kemiripan sifat kimia dan kenaikan massa atom. Hukum Triade berbunyi : “Jika tiga unsur di dalam triade disusun menurut kenaikan massa atomnya, massa atom unsur di tengah (ke-2) sama dengan massa rata-rata dari massa kedua atom yang mengapitnya (massa rata-rata unsur ke-1 dan ke-3)”. Kelemahannya adalah hanya sedikit triade yang ditemukan.
- Pengelompokkan unsur menurut Newlands
Pada tahun 1864 telah ditemukan 63 jenis unsur. Dasar pengelompokkan unsur menurut Newlands adalah kenaikan massa atom relatifnya. “Ternyata unsur-unsur yang berselisih 1 oktaf (unsur nomor 1 dengan nomor 8, 15, 22, 29 ; nomor 2 dengan nomor 9, 16, 23, 30, dan seterusnya ) menunjukkan kemiripan sifat”. Kelemahan Sistem Oktaf adalah sistem ini hanya berlaku untuk unsur-unsur ringan.
| Do
1 |
Re
2 |
Mi
3 |
Fa
4 |
Sol
5 |
La
6 |
Si
7 |
| H | Li | Be | B | C | N | O |
| F | Na | Mg | Al | Si | P | S |
| Cl | K | Ca | Cr | Ti | Mn | Fe |
| Co, Ni | Cu | Zn | I | In | As | Se |
- Pengelompokkan unsur menurut Mendeleev
Tahun 1869 telah dikenal 63 jenis unsur. Dmitri Ivanovich Mendeleev dan Lothar Meyer secara terpisah mengelompokkan unsur-unsur berdasarkan kenaikan massa atom. Menurut Mendeleev : “Jika unsur-unsur disusun berdasarkan kenaikan massa atomnya maka sifat unsur akan berulang secara periodik “.
Kelebihan
- Dapat meramalkan tempat kosong untuk unsur yang belum ditemukan (diberi tanda “?”).
Contoh: Unsur Eka-silikon (Germanium-Ge) berada di antara Si dan Sn.
- Menyajikan data massa atom yang lebih akurat, seperti Be dan U.
Kelemahan : terdapat kolom yang diisi lebih dari 1 unsur
- Sistem Periodik Modern menurut Henry Moseley
Hukum periodik: sifat unsur merupakan fungsi periodik dari nomor atomnya. Sistem periodik modern disusun berdasarkan kenaikan nomor atom dan terbagi atas :
- Golongan (18)
- Periode (7)
Periode adalah lajur yang horizontal.
Menunjukan jumlah kulit elektron. Unsur-unsur yang terletak dalam satu periode memiliki jumlah kulit yang sama.
Golongan adalah lajur yang vertikal
Dalam satu golongan, elektron valensi unsur sama, serta memiliki sifat-sifat kimia dan fisik yang hampir mirip. Golongan terdiri dari: 1) Golongan Utama / Gol A dan 2) Golongan unsur transisi/ Gol B
Untuk slide presentasi mengenai sifat keperiodikan unsur dapat diunduh melalui tautan di bawah ini :