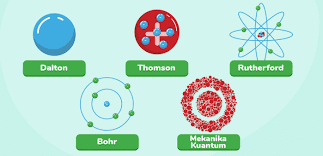
Teori atom modern merupakan teori atom yang sudah didasarkan pada percobaan-percobaan, mulai dari teori atom Dalton, Thomson, Rutherford, Bohr, dan mekanika gelombang. Teori atom didasarkan pada hukum dasar kimia (Hukum Lavoisier, Proust, dan hukum Dalton sendiri). Namun, Dalton tidak hanya dapat menjelaskan hukum dasar kimia, tetapi juga hukum penyatuan volume dan hukum Avogadro. Teori atom Thomson berdasarkan percobaan tabung sinar katoda, Teori atom Rutherford berdasarkan percobaan penembakkan sinar alfa pada suatu lempeng emas tipis, teori atom Bohr didasarkan pada spektrum atom hidrogen, dan teori atom mekanika gelombang didasarkan pada persamaan Heisenberg, hukum Enstein, dan hukum Planck.
Perkembangan teori atom merupakan dasar dalam mempelajari struktur atom dan sistem periodik unsur. Dengan mengetahui perkembangan teori atom, kita bisa mengetahui partikel-partikel penyusun suatu atom. Pemahaman hukum dasar kimia akan memudahkan kita dalam mempelajari materi stoikiometri, dan materi kimia lainnya.
Perkembangan Teori Atom
Filsuf Yunani Democritus (470 – 400 SM) mengungkapkan keyakinannya bahwa semua materi terdiri atas partikel yang sangat kecil dan tidak dapat dibagi lagi, yang ia namakan atomos (berarti tidak dapat dibelah/dibagi). Walaupun gagasan Democritus ini tidak dapat diterima oleh rekan-rekannya, tetapi gagasan ini tetap bertahan. Baru pada tahun 1808, seorang ilmuwan Inggris bernama John Dalton memperoleh bukti percobaan dari penyelidikan ilmiah yang mendukung konsep “atomisme”.
a. Teori Atom Dalton
Pada tahun 1808, John Dalton, seorang ahli kimia di Inggris mengemukakan teori atom. Hipotesis tentang sifat materi yang merupakan landasan teori atom Dalton dapat dirangkumkan sebagai berikut:
1) Unsur tersusun atas partikel yang sangat kecil, yang disebut atom. Semua atom unsur tertentu adalah identik, yaitu mempunyai ukuran, massa, dan sifat kimia yang sama. Atom satu unsur tertentu berbeda dari atom semua unsur yang lain.
2) Senyawa tersusun atas atom-atom dari dua unsur atau lebih. Dalam setiap senyawa, perbandingan antara jumlah atom dari setiap dua unsur yang ada bisa merupakan bilangan bulat atau pecahan sederhana.
3) Yang terjadi dalam reaksi kimia hanyalah pemisahan, penggabungan, atau penyusunan ulang atom – atom; reaksi kimia tidak mengakibatkan penciptaan atau pemusnahan atom.
b. Teori Atom Thomson
Model atom Thomson berdasarkan kepada percobaan tabung sinar katoda (perhatikan Gambar 1.2). Tabung itu berupa tabung kaca yang sebagian besar udaranya sudah disedot keluar. Ketika dua lempeng logam dihubungkan dengan sumber tegangan tinggi, lempeng yang bermuatan negatif, disebut katoda, memancarkan sinar yang tidak terlihat. Sinar katoda ini tertarik ke lempeng bermuatan positif, yang disebut anoda. Sinar itu akan melalui suatu lubang dan terus merambat menuju ujung tabung yang satunya. Ketika sinar ini menumbuk permukaan yang telah dilapisi secara khusus, sinar katoda tersebut menghasilkan pendaran yang kuat, atau cahaya yang terang (Syukri, 1999; Silberberg, 2009; Chang, 2011; Tro, 2011; Jespersen et al., 2012)
c. Teori Atom Ernest Rutherford
Berdasarkan hasil eksperimen Rutherford tentang penghamburan sinar alfa, membuktikan, bahwa massa suatu atom tertumpu pada inti atom yang bermuatan positif. Rutherford menyarankan suatu model atom yang terdiri atas inti (yang terdiri dari proton yang bermuatan positif dan netron yang tidak bermuatan), serta elektron mengelilingi inti.
d. Teori Atom Neils Bohr
Pada tahun 1913, Niels Bohr mengajukan suatu model atom untuk menyempurnakan model atom Rutherford. Penjelasan Bohr didasarkan pada spektrum atom hidrogen yang terdiri atas beberapa garis. Spektrum atom yang berupa garis menandakan bahwa atom tersebut hanya dapat menyerap/memancarkan gelombang elektromagnetik dengan frekuensi tertentu saja. Bohr menyatakan elektron bergerak di sekitar inti atom dengan lintasan berbentuk lingkaran. Hanya lintasan dengan jari-jari dan energi tertentu saja yang diperbolehkan. Elektron yang bergerak pada lintasan yang diperbolehkan tidak memancarkan energi. Elektron dapat berpindah lintasan dengan menyerap atau memancarkan energi.
Bohr melakukan serangkaian percobaan atas dasar postulat Planck tentang cahaya dan spektrum hidrogen yang terdiri dari garis-garis. Menurut Planck cahaya merupakan paket energi yang nilainya bergantung pada frekuensi gelombangnya serta hidrogen dapat menyerap dan memancarkan cahaya dengan energi tertentu.
Untuk materi selengkapnya, kalian dapat mengunduh pada tautan di bawah ini :