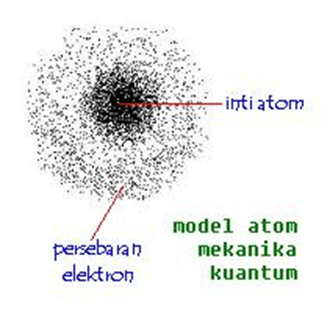
Pada tubuh makhluk hidup, sel adalah bagian terkecil. Dalam ilmu kimia, materi yang terkecil disebut sebagai atom. Atom memiliki ukuran sangat kecil sehingga tidak mungkin dilihat dengan mata telanjang. Hal ini menjadi perhatian serius para ilmuwan, bagaimana bentuk atom yang sebenarnya, bagaimana partikel-partikel di dalamnya saling berinteraksi. Pada artikel sebelumnya telah dibahas tentang sejarah perkembangan teori atom. Teori atom yang dipakai hingga saat ini adalah teori atom mekanika kuantum. Untuk lebih memahaminya, silakan menyimak uraian di bawah ini :
Pada tahun 1923 Louis de Broglie mengemukakan bahwa semua materi memiliki sifat gelombang dan setiap partikel yang bergerak memiliki sifat gelombang dengan panjang gelombang tertentu. Elektron yang bergerak mengelilingi inti, gerakannya seperti sebuah gelombang, keberadaan dalam lintasannya tidak pasti. Hal ini tidak sesuai dengan yang dikemukakan Bohr yaitu elektron bergerak pada lintasan tertentu.
Pada tahun 1926 Erwin Schrodinger dan Werner Heisenberg mengemukakan teori bahwa lokasi elektron dalam atom tidak dapat ditentukan secara pasti, yang dapat ditentukan hanyalah daerah Kemungkinan keberadaan elektron. Oleh karena keberadaan elektron diperkirakan dengan mekanika kuantum maka teori ini disebut teori atom mekanika kuantum.
- Bilangan kuantum dan bentuk orbital
Pada teori atom mekanika kuantum, untuk menggambarkan posisi elektron digunakan bilangan-bilangan kuantum. Daerah kemungkinan elektron berada disebut orbital. Orbital memiliki bentuk yang berbeda-beda.
bilangan kuantum.
Schrodinger menggunakan tiga bilangan kuantum yaitu bilangan kuantum utama (n), bilangan kuantum azimut (l), dan bilangan kuantum magnetik (m). Ketiga bilangan kuantum tersebut menjelaskan tingkat energi, bentuk, dan orientasi elektron di dalam orbital. Selain ketiga bilangan kuantum tersebut ada bilangan kuantum spin (s) yang menunjukkan perputaran elektron pada sumbunya.
- Bilangan kuantum utama (n)
Bilangan kuantum utama memiliki lambang n. Harga n melambangkan tingkat energi elektron atau kulit elektron. Harga n untuk berbagai kulit elektron yaitu sebagai berikut.
Elektron pada kulit ke-1, memiliki harga n = 1.
Elektron pada kulit ke-2, memiliki harga n = 2.
Elektron pada kulit ke-3, memiliki harga n = 3.
Elektron pada kulit ke-4, memiliki harga n = 4
- Bilangan kuantum azimut (l)
Bilangan kuantum azimut memiliki lambang l. Bilangan kuantum azimut menyatakan tingkat energi elektron pada subkulit. Subkulit elektron mempunyai lambang s, p, d, f. Huruf-huruf tersebut berasal dari kata sharp (s), principal (p), diffuse (d), dan fundamental (f) yang diambil dari nama-nama seri spektrum unsur. Harga l untuk berbagai subkulit yaitu sebagai berikut.
Elektron pada subkulit s memiliki harga l = 0
Elektron pada subkulit p memiliki harga l = 1
Elektron pada subkulit d memiliki harga l = 2
Elektron pada subkulit f memiliki harga l = 3
Hubungan harga n dengan l adalah harga l mulai dari 0 sampai dengan n-1.
Contoh:
Jika n = 1 maka l = 0.
Jika n = 2 maka l = 0, 1.
Jika n = 3 maka l = 0, 1, 2.
Jika n = 4, maka l = 0, 1, 2, 3.
- Bilangan kuantum magnetik (m)
Bilangan kuantum magnetik memiliki lambang m yang menunjukkan arah orbital elektron. Bilangan kuantum magnetik menyatakan jumlah orbital pada subkulit elektron. Bilangan kuantum ini bernilai negatif, nol, dan positif. Secara matematika harga m dapat ditulis mulai dari -l sampai dengan +l. Harga m untuk berbagai l atau subkulit dapat dilihat pada Tabel 1.1.
Tabel 1.1 Harga m untuk berbagai subkulit
| Subkulit | Harga ℓ | Harga m | Jumlah Orbital |
| s | 0 | 0 | 1 |
| p | 1 | -1, 0, +1 | 3 |
| d | 2 | -2, -1, 0, +1, +2 | 5 |
| f | 3 | -3, -2, -1, 0, 1, 2, 3 | 7 |
Harga bilangan kuantum n, l, dan m untuk berbagai bilangan kuantum dapat digambarkan seperti Tabel 1.2.
Tabel 1.2 Harga bilangan kuantum n, l, dan m untuk berbagai bilangan kuantum

- Bilangan kuantum spin (s)
Elektron dalam orbital tidak hanya bergerak di sekitar inti tetapi berputar pada
sumbunya. Perhatikan Gambar 1.1

Bilangan kuantum spin dengan lambang s, menyatakan arah perputaran elektron pada sumbunya. Bilangan kuantum suatu elektron di dalam orbital dapat memiliki harga spin + 1/ 2 dan – 1/ 2 , tetapi berdasarkan kesepakatan para tokoh kimia, untuk elektron pertama di dalam orbital harga spinnya = + 1/2.
Berdasarkan harga bilangan kuantum dapat ditentukan berapa jumlah elektron maksimum yang dapat menempati subkulit dan kulit. Perhatikan Tabel 1.3.
Tabel 1.3 Harga Masing- Masing Bilangan Kuantum