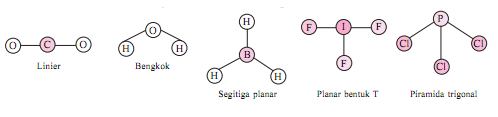
Geometri (bentuk) molekul berkaitan dengan susunan ruang atom-atom dalam molekul.Bentuk geometri molekul dapat diramalkan berdasarkan teori toklak-menolak elektron – elektron pada kulit luar (elektron valensi) atom pusatnya. Berikut ini beberapa bentuk geometri dari beberapa molekul sederhana.

Bentuk geometri suatu molekul dipengaruhi oleh berapa jumlah atom terikat pada atom pusat *jumlah pasangan elektron ikatan = PEI, jumlah pasangan elektron bebas = PEB, dan gaya tolak-menolak antara pasangan elektron*.
1.Teori VSEPR (Valence shell elektron –pair repulsion)
Teori ini menggambarkan susunan geometric dari pasangan elektron di sekitar atom pusat sebagai akibat tolak menolak antara pasangan elektron (Tolakan Pasangan-elektron Kulit Valensi ). Pasangan elektron dalam ikatan kimia ataupun pasangan elektron yang tidak dipakai (bebas) saling tolak-menolak , pasangan elektron cenderung untuk berjauhan satu sama lain. Hal ini menggambarkan arah pasangan elektron terhadap inti suatu atom.
Gaya tolak – menolak antara dua pasang elektron akan semakin kuat dengan semakin kecilnya jarak antara kedua pasang elektron tersebut. Tolakan yang melibatkan pasangan elektron bebas akan lebih kuat daripada yang mmelibatkan pasangan elektron ikatan.
Pengaruh gaya tolak-menolak antar pasangan eklektron di bahas dalam teori pasangan elektron berikut.
2. Teori Pasangan Elektron
Perhatikan gambar berikut:

Berdasarkan gambar di atas, dapat dilihat bahwa : yang menjadi atom pusat adalah atom O (nomor atom 8) sehingga memiliki jumlah elektron valensi 6, dan atom yang terikat pada atom O adalah 2 atom H.
- Atom pusat elektron valensi = 6
- H : pasangan elektron ikatan = 2
- Pasangan elektron bebas = 2
Atom pusat O memiliki 2 pasang elektron bebas yang saling menjauh satu sama lain (teori VSEPR) sehingga pasangan leketron akan mengambil formasi sedemikian rupa sehingga tolak-menolak diantaranya menjadi minimum, dan dihasilkan bentuk molekul H2O adalah planar bentuk V atau “bengkok”.
Prinsip cara meramalkan geometri molekul H2O tersebut adalah berdasarkan tolak-menolak elektron-elektron pada kulit luar atom pusat sebagai berikut:
- Antarpasangan elektron pada kulit luar atom pusat saling tolak menolak sehingga tolak menolak elektron diantaranya menjadi minimum.
- Pasangan elektron bebas mempunyai gaya tolak yang sedikit lebih kuat daripada pasangan elektron ikatan.
Pasangan elektron bebas – pasangan elektron bebas > pasangan eletron bebas – pasangan elektron ikatan > pasangan elektron ikatan – pasangan elektron ikatan.
Jumlah pasangan (pasangan elektron) dalam suatu molekul dapat dinyatakan sebagai berikut.
- Atom pusat dinyatakan dengan lambang A.
- Pasangan elektron ikatan dinyatakan dengan B .
- Pasangan elektron bebas dinyatakan dengan E.
- Jumlah pasangan pasangan elektron ikatan dinyatakan dengan x,
- Jumlah pasangan elektron bebas dinyatakan dengan y,
Secara sederhana rumus bentuk molekul dapat dituliskan :


Sehingga dapat dirumuskan langkah-langkah penentuan bentuk geometri molekul sebagai berikut:
- Menentukan tipe molekul berdasarkan jumlah elektron valensi atom pusat, jumlah pasangan elektron ikatan, dan jumlah pasangan elektron bebas.
Jika atom pusat dimisalkan A, pasangan elektron ikatan B, pasangan elektron bebas E, jumlah pasangan pasangan elektron ikatan adalah x, jumlah pasangan elektron bebas y, maka tipe molekul di rumuskan saebagai : A Bx Ey
Contoh : H2O
Jumlah elektron valensi atom pusat (O) dinyatakan sebagai A = 6
Jumlah pasangan elektron ikatan (atom H) dinyatakan sebagai B = 2
Pasangan pasangan elektron bebas dinyatakan sebagai E
Jumlah pasangan elektron bebas dinyatakan sebagai y = 2
Tipe molekul dirumuskan dengan :AB2E2 ( 4 pasangan )
- Menggambarkan susunan ruang pasangan – pasangan elektron di sekitar atom pusat yang memberi tolakan minimum.

3. Menetapkan pasangan elektron terkait dengan menuliskan lambang atom yang bersangkutan (atom H)
Menentukan geometri molekul setelah mempertimbangkan pengaruh pasangan elektron bebas
( Molekul berbentuk V)