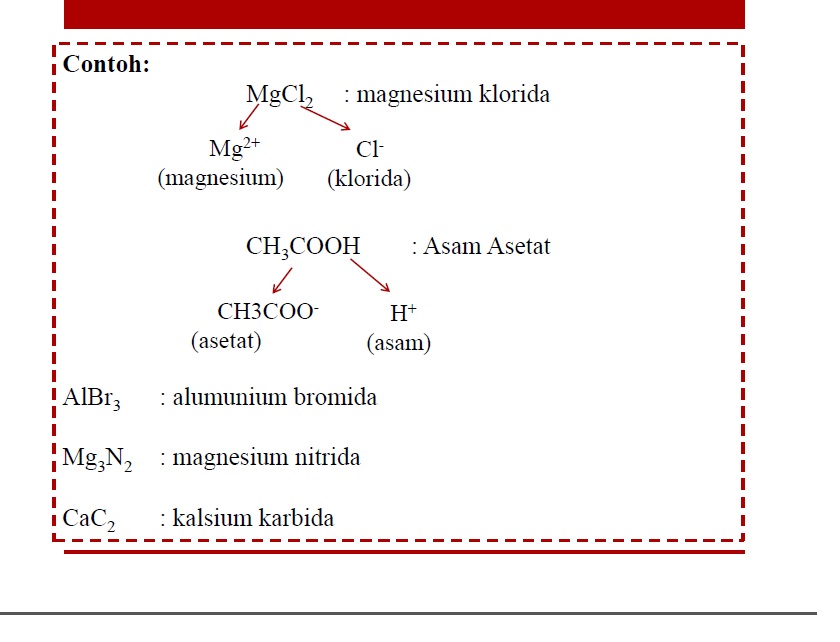
Schrodinger menghasilkan persamaan matematika yang disebut persamaan gelombang untuk atom hidrogen. Dia menggunakan satu set fungsi matematika yang disebut fungsi gelombang (biasanya menggunakan simbol angka Yunani psi, Ψ) yang menunjukkan bentuk dan energi gelombang elektron. Setiap gelombang yang berbedayang mungkin terjadi disebut orbital.
Setiap orbital dalam suatu atom mempunyai energi yang dilukiskan sebagai daerah sekeliling inti dimana elektron diharapkan dapat ditemukan.
Dalam mekanika kuantum, tiga bilangan kuantum diperlukan untuk menggambarkan distribusi elektron dalam atom hidrogen dan atom-atom lainnya. Bilangan-bilangan kuantum ini disebut bilangan kuantum utama, bilangan kuantum momentum sudut, dan bilangan kuantum magnetik. Bilangan-bilangan ini akan digunakan untuk menggambarkan orbital-orbital atom dan menandai elektron-elektron di dalamnya. Bilangan kuantum keempat (bilangan kuantum spin) digunakan untuk mengambarkan perilaku elektron tertentu dan melengkapi gambaran tentang elektron dalam atom.
Adapun 4 bilangan untuk menyatakan suatu orbital, yaitu bilangan kuantum utama (n), bilangan kuantum azimut (ℓ), bilangan kuantum magnetik (m), dan bilangan kuantum spin (s).
1.Bilangan kuantum utama (n)
Bilangan kuantum utama (n) menentukan ukuran dari orbital. Bilangan kuantum utama (n) ini menentukan tingkat energi dengan nilai mulai dari 1, 2, 3, dan seterusnya (bilangan bulat positif) serta dinyatakan dengan lambangK (n = 1), L (n = 2), dan seterusnya.
Bilangan kuantum utama juga berhubungan dengan jarak rata-rata elektron dari inti dalam orbital tertentu. Semakin besar n, semakin besar jarak rata-rata elektron dalam orbital tersebut dari inti dan oleh karena itu semakin besar orbitalnya sehingga tingkat energinya pun semakin besar pula. Elektron-elektron yang memiliki nilai n sama terletak pada kulit yang sama.
2. Bilangan Kuantum azimut (ℓ)
Mekanika kuantum menentukan bahwa setiap kulit terdiri dari subkulit atau subtingkat, dimana setiap subkulit ditunjukkan oleh angka kuantum kedua yang disebut bilangan kuantum azimut (ℓ).Bilangan kuantum azimut disebut juga bilangan kuantum ruang dari orbital. Nilai ℓ=0 sampai dengan (n–1).
Adapun nilai-nilai subkulit dapat dilihat pada tabel berikut
| Kulit | Nilai n | Nama orbital | Sub kulit | Nilai (ℓ) | Jumlah elektron
tiap orbital |
| K | 1 | s (sharp) | s2 | 0 | Orbital s = 2 elektron |
| L | 2 | p (principal) | s2, p6 | 1 | Orbital p = 8 elektron |
| M | 3 | d (diffuse) | s2, p6, d10 | 2 | Orbital d = 18 elektron |
| N | 4 | F (fundamental) | s2, p6, d10, f14 | 3 | Orbital f = 32 elektron
|
3. Bilangan kuantum magnetik (m)
Setiap subkulit terdiri dari satu atau lebih orbital. Setiap orbital dalam subkulit tertentu dibedakan dari nilai m yang menunjukkan orientasinya dalam ruang relatif terhadap orbital lain. Bilangan kuantum magnetik (m), menyatakan banyak dan posisi/orientasi orbital.
Bilangan kuantum magnetik menggambarkan orientasi orbital dalam ruang. Di dalam satu subkulit, nilai m tergantung pada nilai bilangan kuantum azimut (ℓ). Untuk nilai l akan memiliki nilai (2l + 1) dengan rentang : -l, (-l+1),…0, … (+l-1), + l. Adapun nilai-nilai bilangan magnetik dapat dilihat pada tabel di bawah ini.
| Subkulit | s | p | d | f |
| Harga | 0 | -1 s.d +1 | -2 s.d +2 | -3 s.d +3 |
| Diagram | ||||
| Total Orbital | 1 | 3 | 5 | 7 |
| Elektron maksimal | 2 | 6 | 10 | 14 |
- Bilangan kuantum spin (s)
Bilangan kuantum ini ditemukan dari hasil pengamatan radiasi uap perak yang dilewatkan melalui medan magnet, oleh Otto Stern dan W. Gerlach. Pada medan magnet, berkas cahaya dari uap atom perak terurai menjadi dua berkas. Satu berkas membelok ke kutub utara magnet dan satu berkas lagi ke kutub selatan magnet. Berdasarkan pengamatan tersebut, disimpulkan bahwa atom-atom perak memiliki sifat magnet. Pengamatan terhadap atom-atom unsur lain, seperti atom Li, Na, Cu, dan Au selalu menghasilkan gejala yang serupa. Atom-atom tersebut memiliki jumlah elektron ganjil. Munculnya sifat magnet dari berkas uap atom disebabkan oleh spin atau putaran elektron pada porosnya.
Berdasarkan percobaan Stern-Gerlach, dapat disimpulkan bahwa ada dua macam spin elektron yang berlawanan arah dan saling meniadakan. Pada atom yang jumlah elektronnya ganjil, terdapat sebuah elektron yang spinnya tidak ada yang meniadakan. Akibatnya, atom tersebut memiliki medan magnet.
Spin elektron dinyatakan dengan bilangan kuantum spin. Bilangan kuantum ini memiliki dua harga yang berlawanan tanda, yaitu +1/2 dan – 1/2. Tanda (+) menunjukkan putaran searah jarum jam dan tanda (–) arah sebaliknya (perhatikan Gambar 2). Adapun harga 1/2, menyatakan fraksi elektron.