A. Massa Atom Relatif
Massa atom bergantung pada jumlah elektron, proton, dan neutron yang dikandungnya. Namun anda tidak dapat mengukur massa atom dengan menggunakan neraca seperti saat anda mengukur massa dari suatu materi, karena ukurannya yang sangat kecil. Oleh sebab itu, untuk menentukan massa suatu atom tidak mungkin dilakukan dengan mengambil satu atom lalu menimbangnya.
Atom-atom unsur yang sama tidak selalu memiliki massa yang sama. Seperti halnya biji-bijian. Hal ini menyebabkan kita tidak dapat menghitung massa dari satu atom, melainkan kita hanya dapat menghitung *massa rata-rata atom. Perbedaan massa yang terjadi akibat dari adanya fenomena isotop unsur, dimana kita ketahui bahwa atom unsur dengan nomor atom yang sama memiliki massa yang berbeda-beda. Seperti yang sudah disebutkan diatas dimana massa tersebut bergantung pada jumlah elektron, proton, dan neutron yang dikandungnya.
Hal-hal yang telah dikemukakan tersebut kemudian mendasari munculnya Konsep Massa Atom Relatif dengan lambang Ar. Dimana konsep massa atom relatif ini dimunculkan untuk mengetahui massa atom suatu unsur dan menyederhanakan nilai massa tersebut. Dalam konsep massa atom relatif, nilai massa atom unsur atau massa rata-rata seluruh isotop suatu atom dibandingkan terhadap massa atom lain. Pada mulanya, sebagai standar pertama untuk massa atom relatif digunakan hidrogen, yang diberikan nilai 1 sma pada skalanya. Kemudian standar hidrogen diganti dengan oksigen. Dan ditetapkan massa atom relatif oksigen adalah enam belas satuan pada skala hidrogen.
Namun setelah penemuan spektrometer massa dibuktikan bahwa standar oksigen sudah tidak tepat, karena kenyataannya oksigen di alam terdiri dari campuran isotop , , dengan kelimpahan relatif berturut-turut 99,76% ; 0,04% ; dan 0,20%. Sedangkan syarat untuk menjadi massa standar adalah murni dan stabil.
Akhirnya menurut persetujuan internasional 1960, sejak 1961 digunakan isotop karbon-12 sebagai standar, dan menurut skala ini isotop karbon ditetapkan tepat 12 satuan. Setelah diteliti dengan cermat, 1 s.m.a = 1,66 x 10-24 g dan massa isotop C-12 = 1,99 x 10-23 . Alasan dipilihnya isotop karbon-12 sebagai massa standar adalah karena memenuhi syarat sebagai massa standar yaitu isotop karbon-12 ditemukan dialam dalam keadaan stabil dan murni.
| Sesuai dengan skala karbon yang disepakati secara internasional maka massa atom relatif suatu unsur adalah massa rata-rata suatu atom unsur berdasarkan kelimpahan isotop relatif terhadap 1/12 massa isotop karbon-12 yang ditetapkan 12,00 s.m.a.
|
Secara matematis dapat dituliskan sebagai berikut:
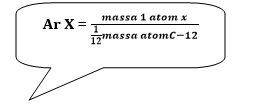
| Penting untuk diketahui pada skala ini massa atom relatif tidak mempunyai satuan, karena bukan massa atom yang sebenarnya tetapi merupakan hasil perbandingan antara massa atom rata-rata dengan satuan massa atom. |

Massa Atom Rata-rata
Seperti yang telah diketahui pada perkembangan penentuan satuan massa atom, bahwa pada kenyataannya unsur-unsur yang terdapat dialam terdiri dari beberapa isotop. Sehingga saat dilakukan penghitungan massa dari unsur oksigen maka yang sebenarnya kita peroleh adalah massa rata-rata dari semua isotop unsur oksigen. Begitu pula untuk unsur-unsur yang lain. Secara umum untuk menentukan massa atom rata-rata suatu unsur adalah sebagai berikut :
| massa atom rata-rata unsur A = (Kelimpahan isotop–1 unsur A) X (massa isotop–1 unsur A) + (Kelimpahan isotop–2 unsur A) X ( massa isotop–2 unsur A) |
| Catatan: untuk perhitungan ini kelimpahan isotop unsur yang umumnya dinyatakan dalam persen harus diubah terlebih dahulu menjadi angka desimal sebelum digunakan dalam perhitungan ini. |

B. Massa Molekul Relatif
Anda tentu sudah mengenal istilah molekul, dimana molekul merupakan salah satu partikel penyusun materi. Sama halnya seperti atom, molekul sebagai partikel penyusun materi tentu memiliki massa juga. Sama halnya seperti atom, massa dari molekul juga tidak dapat diukur dengan neraca.
Secara singkat dapat dikatakan bahwa
| massa molekul relatif adalah massa rata-rata molekul menurut skala karbon-12. |
Sehingga secara matematis hubungannya di tuliskan sebagai berikut :
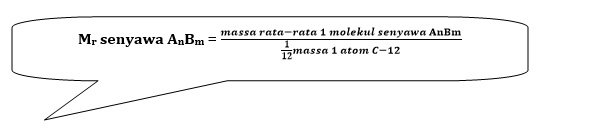
| Massa molekul relatif dapat dikatakan sebagai jumlah massa atom realtif dari semua atom dalam molekul senyawa itu. |
| Mr senyawa AnBm = n . Ar A + m . Ar B |
Contoh Kasus :
Hitung massa molekul relatif senyawa H2O , jika diketahui Ar H = 1, O = 16.
Penyelesaian :
Mr H2O = ( 2 x Ar H ) + (1 x Ar O) = ( 2 x 1 ) + ( 1 x 16) = 18
Contoh Kasus :
Kelimpahan alami dari karbon-12 dan karbon-13 masing-masing adalah 98,93 persen dan 1,07 persen. Massa atom karbon-12 telah diketahui sebesar 1,99 x 10-23 gram dan karbon-13 2,1584 x 10-23gram. Tentukan massa atom rata-rata karbon?
Penyelesaian :
Massa atom rata-rata dari karbon alam:
= (0,9893)( 1,99 x 10-23 gram) + (0,0107)( 2,1584 x 10-23gram)
= 1,99359 x 10-23 gram