Prinsip utama dalam industri adalah bagaimana caranya menghasilkan produk (hasil) seoptimal mungkin.Hal tersebut dapat di capai dengan memodifikasi reaksi kimia yang terjadi.
Dalam industri yang melibatan reaksi kesetimbangan kimia, produk reaksi yang di hasilkan ketika campuran reaksi kesetimbangan mencapai kesetimbangan tidak akan bertambah lagi. Akan tetapi, produk reaksi akan kembali di hasilkan, jika di lakukan perubahan konsentrasi (produk reaksinya di ambil atau pereaksi di tambah), perubahan suhu, atau perubahan tekanan dan volume. Berikut ini beberapa contohnya :
1.Proses Haber pada Industri amonia
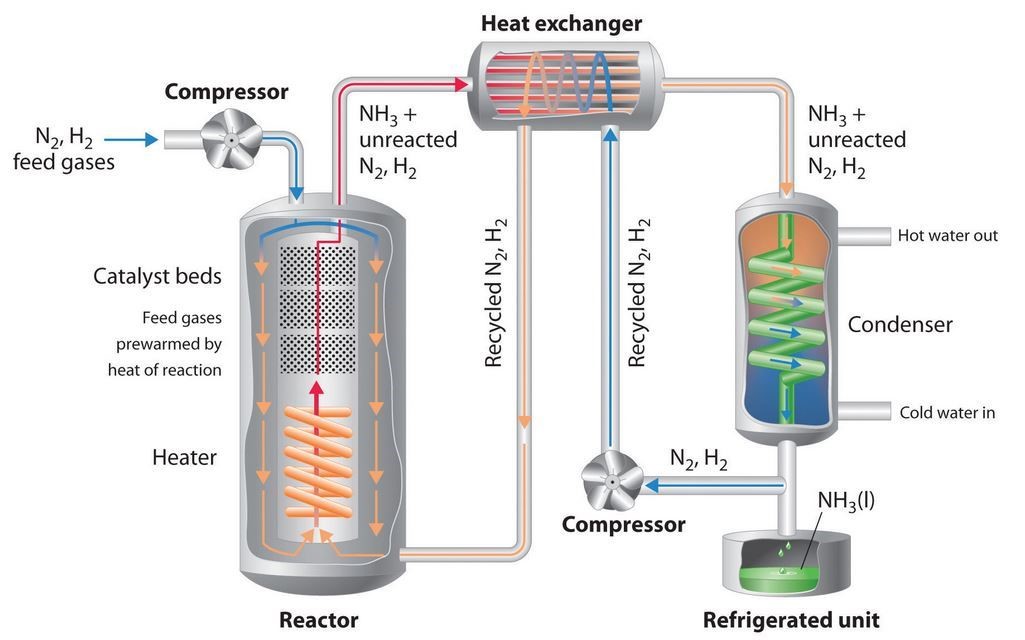
 Nitrogen sangat di perlukan untuk kelangsungan hidup makhluk hidup. Sebelum perang dunia 1, dunia kekurangan senyawa nitrogen. Setelah itu, sumber nitrogen dapat di produksi secara besar-besaran melalui sintesis amonia. Fritz haber merupakan ilmuwan yang paling berjasa dalam industry ammonia tersebut. Dia menerapkan azas Le Chatelier untuk merancang Industri ammonia yang di kenal dengan proses Haber. Ammonia di buat dengan cara mereaksikan nitrogen dan oksigen. Reaksi tersebut menerapkan prinsip kesetimbangan.
Nitrogen sangat di perlukan untuk kelangsungan hidup makhluk hidup. Sebelum perang dunia 1, dunia kekurangan senyawa nitrogen. Setelah itu, sumber nitrogen dapat di produksi secara besar-besaran melalui sintesis amonia. Fritz haber merupakan ilmuwan yang paling berjasa dalam industry ammonia tersebut. Dia menerapkan azas Le Chatelier untuk merancang Industri ammonia yang di kenal dengan proses Haber. Ammonia di buat dengan cara mereaksikan nitrogen dan oksigen. Reaksi tersebut menerapkan prinsip kesetimbangan.
Pada proses haber, bahan bakunya berasal dari gas alam, air, dan udara. Gas hirogen di peroleh dari reaksi gas alam (mengandung metana) dengan uap air, sedangkan gas nitrogen di peroleh dari udara.
CH4 + H2O CO + 3H2
Gas CO yang terbentuk di reaksikan lagi dengan uap air sehingga menghasilkan gas H2 dan gas CO2.
CO + H2O CO2 + H2
Gas H2 di gunakan untuk membuat ammonia, sedangkan gas Co2 yang di hasilkan di gunakan untuk memproduksi urea CO(NH2)2. Reaksi nitrogen dan hydrogen di lakukan pada suhu 450oC di bantu oleh katalis (besi oksida) dengan reaksi kesetimbangan sebagai berikut.
N2 (g) + 3H2 (g) 2NH3 ΔH = -92 kJ
Agar hasil produksi optimal, reaksi harus bergeser ke kanan. Oleh karena itu, tekanan yang di gunakan dalam proses tersebut sangat tinggi sekitar 300-400 atm. Jika tekanan di perbesar, reaksi akan bergeser ke arah jumlah mol yang lebih kecil (NH3 / amonia). Selain itu, suhu reaksi di turunkan sehingga reaksi bergeser ke kanan. Cara lainnya dengan mengambil produk yang terbentuk sehingga konsentrasi NH3 berkurang. Pengurangan konsentrasi NH3 akan menggeser kesetimbangan ke arah kanan. Selin itu, untuk menghasilkan produk yang lebih optimal, pada proses pembuatan ammonia di tambahkan katalis. Katalis tersebut berfungsi untuk mempercepat terjadinya reaksi atau memepercepat laju reaksi. Katalis yang biasa di gunakan adalah Fe dengan campuran Al2O3 dan KOH.
2. Proses Kontak pada Pembuatan Asam Sulfat
Asam sulfat merupakan salah satu bahan kimia yang banyak di gunakan baik di labolatorium maupun Industri. Penggunaan utama asam sulfat di industry adalah sebagai bahan baku pembuatan pupuk, di antaranya pupuk superfosfat dan ammonium sulfat. Asam sulfat juga di gunakan sebagai bahan baku dalam pembuatan asam klorida, asam nitrat, garam sulfat, detergen, zat pewarna, bom, dan obat-obatan.
Bahan baku utama pembuatan asam sulfat adalah belarang trioksida (SO3). SO3 sendiri di hasilkan dari reaksi antara belerang dioksida dan oksigen. Metode pembuatan asam sulfat dengan cara ini di namakan proses kontak yang terdiri atas 3 tahap, yaitu pembuatan SO2, pembuatan SO3, dan pembuatan H2SO4 (asam sulfat). Untuk mempercepat reaksi, di gunakan katalisator vanadium pentaoksida (V2O5).
Tahap 1 : Oksidasi S
S (s) + O2 (g) SO2 (g) ΔH = -297 kJ
Tahap 2 : oksidasi SO2
2SO2 (g) + O2 (g) 2SO3 (g) ΔH = -190 kJ
Untuk memperoleh keuntungan optimal, SO3 yang di hasilkan harus optimal juga sehingga perlu di cari kondisi yang optimum agar reaksi berlangsung ke kanan. Bagaimana caranya ? setelah mencapai kesetimbangan, tekanan di perbesar dan suhu reaksi di turunkan.
Tahap 3 : pembentukan H2SO4
Pada tahap terakhir ini, belerang trioksida di reaksikan dengan asam sulfat pekat menghasilkan asam pirosulfat.
SO3 (g) + H2SO4 (aq) H2S2O7 (l)
Asam sulfat di peroleh kembali dengan cara mereaksikan asam pirosulfat dengan air. Kadar asam sulfat yang di hasilkan sekitar 98%.
H2S2O7 (l) + H2O (l) 2H2SO4 (aq)
3.Proses Ostwald pada Industri asam nitrat
Asam nitrat di gunakan dalam pembuatan pupuk amonium nitrat, bahan peledak seperti nitrogliserin dan trinitrotoluene (TNT), Industri zat warna, dan metalurgi. Asam Nitrat dapat di buat dengan cara mereaksikan NO2 dan air. Metode yang biasa di gunakan adalah proses Ostwald yang terdiri atas tiga tahap reaksi. Tahap-tahap reaksi ersebut merupakan reaksi kesetimbangan.
Tahap 1: oksidasi ammonia
Biasanya, proses pembuatan asam nitrat satu paket dengan pembuatan ammonia karena sebagian ammonia yang di hasilkan di oksidasi untuk menghasilkan gas nitrogen monoksida. Pada reaski ini, suhu reaksi sekitar 900oC dan di gunakan katalis platina dan rhenium.
4NH3 (g) + 5O2 (g) 4NO (g) + 6H2O (l) ΔH = -907 kJ
Untuk menghasilkan hasil optimum, suhu reaksi di turunkan dan tekanan di perbesar.
Tahap 2: oksidasi gas NO
Gas NO yang terbentuk selanjutnya di campukan dengan udara agar dapat bereaksi dengan oksigen.
2NO (g) + O2 (g) 2NO2 (g) ΔH = -114 kJ
Untuk menghasilkan gas NO optimum, duhu reaksi di tutunkan dan tekanan di perbesar.
Tahap 3: pembentukan HNO3
Pada tahap akhir ini, gas NO2 di reaksikan dengan air menghasilkan asam nitrat dan gas NO.
3NO2 (g) + H2O (l) 2HNO3 (aq) + NO (g)

TERIMAKASIH SHARING MATERINYA, INI SANGAT BERMANFAAT UNTUK MEMAHAMI PROSES KESETIMBANAGN KIMIA DI INDUSTRI