Reaksi kimia seringkali digunakan untuk mempermudah dalam melakukan pekerjaan ataupun untuk menghasilkan suatu barang dengan kualitas yang lebih baik, baik itu dalam bidang rumah tangga, industri, ataupun usaha kecil. Salah satunya adalah reaksi elektrolisis.
Reaksi elektrolisis adalah reaksi yang memanfaatkan energi listrik agar terjadi reaksi kimia pada suatu reaksi yang sifatnya tidak spontan. Prinsip elektrolisis ini dapat digunakan sebagai dasar untuk melakukan perbaikan kualitas dari suatu logam, termasuk perhiasan ataupun pajangan agar terlihat indah dan seperti baru. Salah satunya adalah proses penyepuhan logam. Bagaimana prosesnya?
Seniman pembuat perhiasan menggunakan kimia penyepuhan logam untuk melapisi logam yang kurang bernilai dengan yang lebih berharga. Bahan dasar yang akan dilapisi biasanya logam yang tidak mahal seperti tembaga. Gold plating atau penyepuhan emas adalah metode memberikan lapisan tipis emas ke permukaan logam lain, biasanya tembaga atau perak, dengan menggunakan bahan kimia. Proses ini dapat berlangsung berbulan-bulan dan bahkan bertahun-tahun, tergantung pada ketebalan lapisan emas.
1.Susunan sel elektrolisis
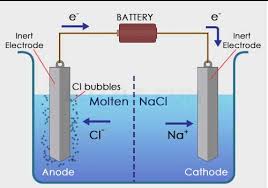
 Sel elektrolisis terdiri dari sebuah wadah, elektrode, elektrolit dan sumber arus searah dengan susunan seperti pada gambar di bawah ini.
Sel elektrolisis terdiri dari sebuah wadah, elektrode, elektrolit dan sumber arus searah dengan susunan seperti pada gambar di bawah ini.
Elektron (listrik) memasuki sel elktrolisis melalui kutub negatif (katoda). Spesi tertentu dalam larutan menyerap elektron dari katode dan mengalami reduksi. Sementara itu, spesi lain melepas elektron di anode dan mengalami oksidasi.
Jadi, sama seperti pada sel volta, reaksi di katode adalah reduksi, sedangkan reaksi di anode adalah oksidasi. Akan tetapi, muatan elektrodenya berbeda. Pada sel volta, katode bermuatan positif, sedangkan anode bermuatan negatif. Pada sel elektrolisis, katode bermuatan negatif, sedangkan anode bermuatan positif.
2.Reaksi-reaksi Elektrolisis
Reaksi elektrolisis terdiri dari reaksi katode, yaitu reduksi, dan reaksi anode, yaitu oksidasi. Spesi apa yang terlibat dalam reaksi katode dan anode bergantung pada potensial elektrode dari spesi tersebut, dengan ketentuan sebagai berikut:
- Spesi yang mengalami reduksi di katode adalah spesi yang potensial reduksinya paling besar.
- Spesi yang mengalami oksidasi dari anode adalah spesi yang potensial oksidasinya paling besar.
Berdasarkan ketentuan tersebut, kita daoat meramalkan reaksi-reaksi elektrolisis. Namun demikuan, perlu juga diapahami bahwa potensial elektrode juga dipengaruhi konsentrasi dan jenis elektrodenya.
a.Reaksi-reaksi di Katode (Reduksi)
Reaksi di katode bergantung pada jenis kation dalam larutan. Jika kation berasal dari logam-logam aktif (logam golongan IA, IIA, Al dan Mn), yaitu logam-logam yang standar reduksinya lebih kecil (lebih negatif daripada air), maka air yang tereduksi. Sebaliknya, kation selain yang disebutkan di atas akan tereduksi.
b.Reaksi-reaksi di Anode (Oksidasi)
Elektrode negatif (katode) tidak mungkin ikut bereaksi selama elektrolisis karena logam tidak ada kecenderungan menyerap elektron membentuk ion negatif. Akan tetapi, elektrode positif (anode) mungkin saja ikut bereaksi, melepas elektron dan mengalami oksidasi. Kecuali Pt dan Au, pada umumnya logam mempunyai potensial oksidasi lebih besar daripada air atau anion sisa asam. Oleh karena itu, jika anode tidak terbuat dari Pt, Au atau grafit, maka anode itu akan teroksidasi.
Elektrode Pt, Au dan grafit (C) digolongkan sebagai elektrode inert (sukar bereaksi). Jika anode terbuat dari elektrode inert, maka reaksi anode bergantung pada jenis anion dalam larutan. Anion sisa asam oksi seperti SO42- , NO3-, PO43- dan F– mempunyai potensial oksidasi lebih negatif daripada air. Anion-anion seperti itu sukar dioksidasi sehingga air yang tereduksi. Jika anion lebih mudah dioksidasi daripada air, seperti Br– dan I– maka anion itu yang teroksidasi.
Secara keseluruhan, reaksi yang terjadi pada elektrode dalam reaksi elektrolisis dapat dirangkum dalam gambar berikut :