Kinetika kimia merupakan cabang dari ilmu kimia yang mempelajari sistem kimia yang tergantung pada waktu, seperti sistem yang memiliki komposisi kimia yang berubah selama perubahan waktu tertentu. Kinetika kimia membicarakan dinamika reaksi yang meliputi laju reaksi, orde reaksi yang diperoleh dari hasil percobaan, hukum atau persamaan laju, konstanta laju dan mekanisme reaksi (Mon, I., dkk., 2012).
Laju reaksi berhubungan dengan cepat atau lambatnya suatu reaksi terjadi. Dalam ilmu fisika dikenal dengan istilah “kecepatan”, yaitu perbandingan antara jarak yang ditempuh dengan waktu. Misalnya seseorang yang mengendarai sepeda motor menempuh jarak 100 km selama 2 jam, maka kecepatan rata-rata dari sepeda motor tersebut adalah 50 km/jam. Artinya, setiap 1 jam jarak yang ditempuh sepeda motor bertambah 50 km. Pengertian laju dalam reaksi hampir sama dengan pengertian kecepatan, tetapi yang membedakan adalah, untuk kecepatan (v) yang dihitung adalah perubahan jarak persatuan waktu sedangkan laju (r) yang dihitung adalah perubahan konsentrasi persatuan waktu.Laju reaksi adalah konsentrasi pereaksi yang bereaksi tiap satuan waktu, atau konsentrasi hasil reaksi yang dihasilkan tiap satuan waktu. Setiap reaksi kimia dapat dinyatakan dengan persamaan umum:
Reaktan → Produk
Dari persamaan ini dapat kita ketahui bahwa selama reaksi berlangsung molekul reaktan bereaksi sedangkan molekul produk terbentuk.
Amatilah Gambar 1 yang merupakan grafik dari reaksi : A → B
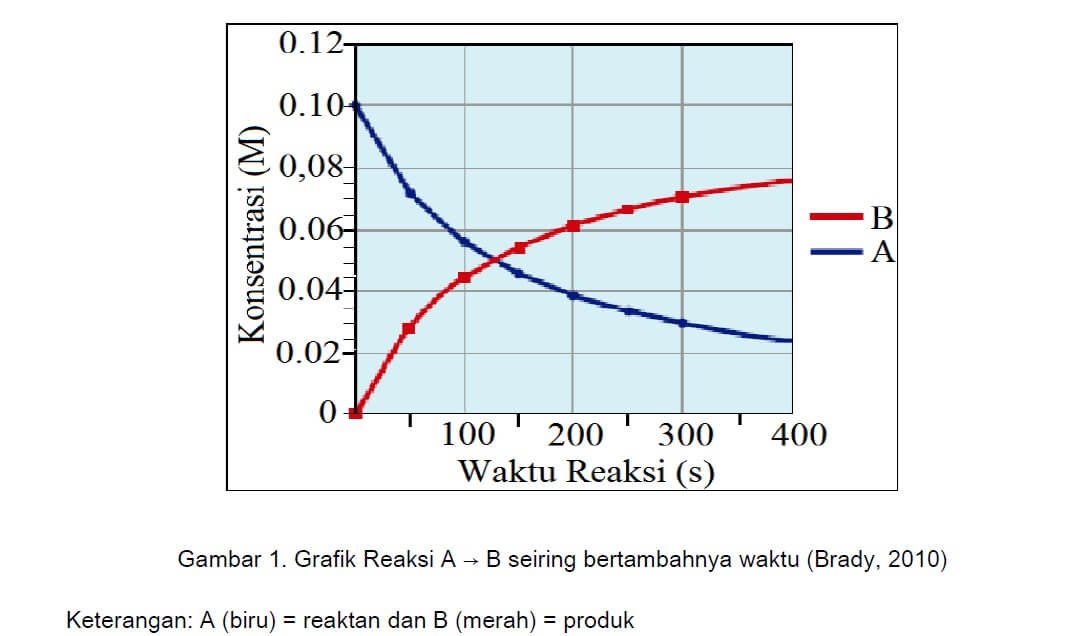
Reaksi kimia terjadi karena adanya tumbukan antara partikel pereaksi, tumbukan ini akan menghasilkan produk. Dalam suatu perubahan kimia, tumbukan efektif akan mempengaruhi berkurangnya reaktan dan terbentuknya produk.
Teori tumbukan menggambarkan pertemuan partikel-partikel pereaksi sebagai suatutumbukan.Tumbukan ada yang menghasilkan reaksi dan ada yang tidak menghasilkan reaksi.Tumbukan yang menghasilkan partikel-partikel produk reaksi disebut tumbukan efektif. Faktor-faktor yang menentukan tumbukan efektif yaitu energi kinetik partikel (molekul) dan orientasi atau arah partikel. Kemudian dijelaskan juga bahwa Laju reaksi kimia tergantung pada hasil kali frekuensi tumbukan dengan fraksi molekul yang memiliki energi sama atau melebihi energi pengaktifan. Karena fraksi molekul yang teraktifkan biasanya sangat kecil, maka laju reaksi jauh lebih kecil daripada frekuensi tumbukannya sendiri. Semakin tinggi nilai energi pengaktifan, semakin kecil fraksi molekul yang teraktifkan dan semakin lambat reaksi berlangsung Molekul-molekul harus mempunyai orientasi tertentu agar tumbukan efektif untuk menghasilkan reaksi kimia.













