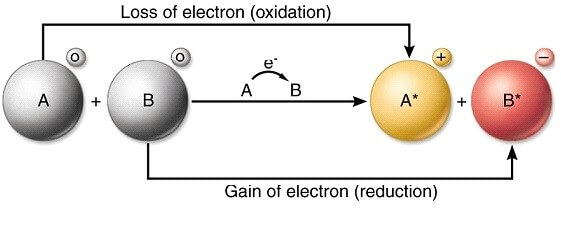
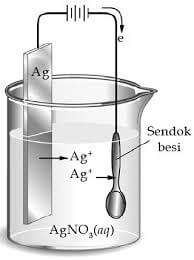
Reaksi redoks merupakan reaksi kimia yang disertai perubahan bilangan oksidasi. Elektrokimia merupakan salah satu dari cabang ilmu kimia yang melibatkan reaksi redoks. Proses transfer elektron akan menghasilkan sejumlah energi listrik. Aplikasi elektrokimia dapat diterapkan dalam dua jenis sel, yaitu sel volta dan sel elektrolisis.
Berikut merupakan beberapa contoh reaksi redoks :
- Reaksi redoks sederhana
- N2 (g) + H2(g) → NH3 (g)
- Zn (s) + CuSO4 (aq) → ZnSO4 (aq) + Cu (s)
Pada reaksi redoks sederhana, penyetaraannya tidak terlalu rumit sehingga lebih mudah untuk disetarakan. Reaksi setara untuk reaksi di atas adalah :
1. N2 (g) + 3H2(g) → 2NH3 (g)
2. Zn (s) + CuSO4 (aq) → ZnSO4 (aq) + Cu (s)
- Reaksi redoks kompleks
- MnO + PbO2 → MnO4– + Pb2+ (suasana asam)
- Zn + NO3– → ZnO22- + NH3 (suasana basa)
Pada reaksi sederhana lebih mudah untuk disetarakan, sedangkan pada reaksi redoks yang kompleks, diperlukan beberapa langkah untuk menyetarakan reaksinya.
Reaksi kimia yang disertai perubahan bilangan reduksi-oksidasi atau reaksi redoks. Reduksi yaitu penurunan bilangan oksidasi atau penyerapan elektron, sedangkan oksidasi yaitu kenaikan bilangan oksidasi atau pelepasan elektron. Reaksi redoks ada yang dapat berlangsung spontan, ada juga yang tidak spontan. Reaksi redoks spontan dapat diguakan sebagai sumber arus, yaitu dalam sel volta seperti baterai dan aki. Deperti yang telah dikemukakan, banyak reaksi redoks yang sukar disetarakan dengan cara menebak. Untuk menetarakan persamaan reaksi redoks, diperlukan cara-cara khusus, yaitu dengan metode bilangan oksidasi dan metode setengah reaksi
Menyetarakan Persamaan Reaksi Redoks
Persamaan reaksi redoks dikatakan setara jika jumlah atom dan jumlah muatan di ruas kiri sama dengan jumlah atom dan jumlah muatan di ruas kanan. Pada dasarnya reaksi redoks berlangsung di dalam pelarut air sehingga penyetaraan persamaan reaksi redoks selalu melibatkan ion H+ dan OH–. Terdapat dua metode untuk menyetarakan reaksi redoks, yaitu dengan metode setengah reaksi dan cara bilangan oksidasi.
Langkah – langkah/ tahapan penyetaraan reaksi dapat kalian baca di :
Contoh penyelesaian penyetaraan reaksi redoks baik dengan metode bilangan oksidasi maupun setengah reaksi dapat kalian simak dengan mengunduh dokumen di bawah ini :