Pernahkah kalian memperhatikan komposisi cuka yang sering dipakai sebagai penyedap makanan?

Pada botol cuka biasanya tertera persentase(kadar) cuka yang terdapat di dalamnya. Untuk mengecek kadar cuka yang tertera di labelnya tersebut sesuai atau tidak, maka dapat dilakukan dengan prosedur titrasi asam basa. Apa itu titrasi asam basa? Mari kita simak bersama.
Prinsip Titrasi Asam basa
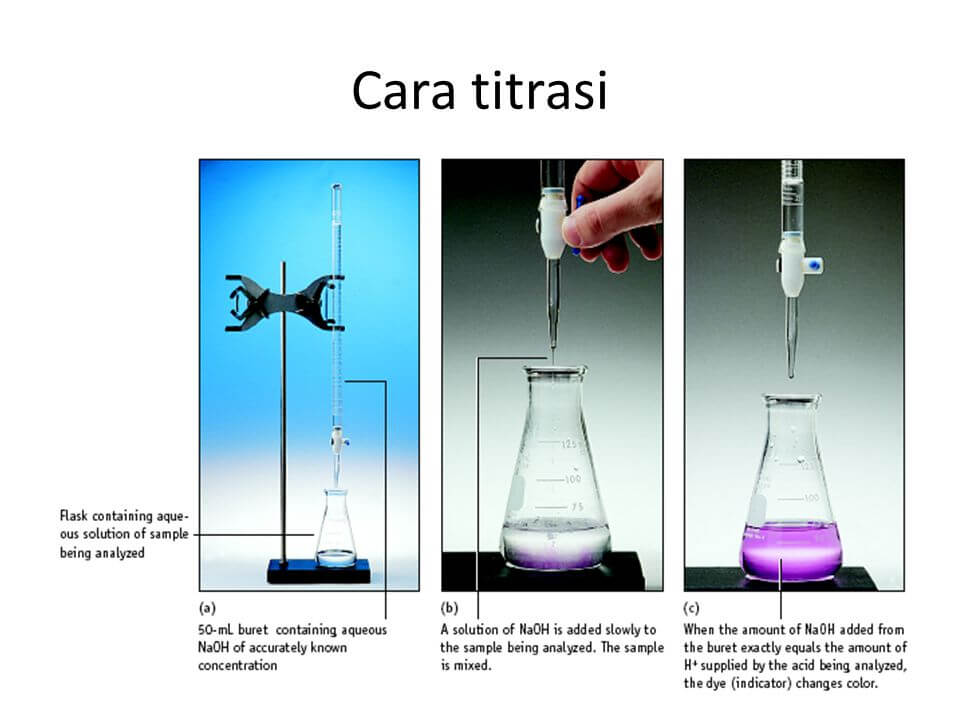
Titrasi asam basa melibatkan asam maupun basa sebagai titer ataupun titrant. Titer adalah larutan baku standar yang sudah diketahui kemolaran (molaritasnya). Titrant adalah larutan yang ingin ditentukan konsentrasinya. Titrasi asam basa berdasarkan reaksi penetralan. Kadar larutan asam ditentukan dengan menggunakan larutan basa dan sebaliknya.
Titrant ditambahkan titer sedikit demi sedikit sampai mencapai keadaan ekuivalen ( artinya secara stoikiometri titrant dan titer tepat habis bereaksi). Keadaan ini disebut sebagai “titik ekuivalen”.
Pada saat titik ekuivalent ini maka proses titrasi dihentikan, kemudian kita mencatat volume titer yang diperlukan untuk mencapai keadaan tersebut. Dengan menggunakan data volume titrant, volume dan konsentrasi titer maka kita bisa menghitung kadar titrant.
Cara Mengetahui Titik Ekuivalen
Ada dua cara umum untuk menentukan titik ekuivalen pada titrasi asam basa.
- Memakai pH meter untuk memonitor perubahan pH selama titrasi dilakukan, kemudian membuat plot antara pH dengan volume titrant untuk memperoleh kurva titrasi. Titik tengah dari kurva titrasi tersebut adalah “titik ekuivalen”.
- Memakai indikator asam basa. Indikator ditambahkan pada titrant sebelum proses titrasi dilakukan. Indikator ini akan berubah warna ketika titik ekuivalen terjadi, pada saat inilah titrasi kita hentikan.
Pada umumnya cara kedua dipilih disebabkan kemudahan pengamatan, tidak diperlukan alat tambahan, dan sangat praktis.
Indikator yang dipakai dalam titrasi asam basa adalah indikator yang warnanya dipengaruhi oleh pH. Penambahan indikator diusahakan sesedikit mungkin dan umumnya adalah dua hingga tiga tetes.
Untuk memperoleh ketepatan hasil titrasi maka titik akhir titrasi dipilih sedekat mungkin dengan titik ekuivalen, hal ini dapat dilakukan dengan memilih indikator yang tepat dan sesuai dengan titrasi yang akan dilakukan.
Keadaan saat titrasi dihentikan karena sudah ada perubahan warna indikator disebut sebagai “titik akhir titrasi”.
Rumus Umum Titrasi
Pada saat titik ekuivalen maka mol-ekuivalen asam akan sama dengan mol-ekuivalen basa, maka hal ini dapat kita tulis sebagai berikut:
mol-ekuivalen asam = mol-ekuivalen basa
Mol-ekuivalen diperoleh dari hasil perkalian antara Normalitas dengan volume maka rumus diatas dapat kita tulis sebagai:
NxV asam = NxV basa
Normalitas diperoleh dari hasil perkalian antara molaritas (M) dengan jumlah ion H+ pada asam atau jumlah ion OH pada basa, sehingga rumus diatas menjadi:
nxMxV asam = nxMxV basa
keterangan :
N = Normalitas
V = Volume
M = Molaritas
n = jumlah ion H+ (pada asam) atau OH – (pada basa)
Anda bisa menggunakan rumus diatas bila anda menhadapi soal-soal yang melibatkan titrasi.
| Contoh Soal Titrasi
Titrasi adalah cara penetapan kadar suatu larutan dengan menggunakan larutan standar yang sudah diketahui konsentrasinya. Motode ini banyak dilakukan di laboratorium. Beberapa jenis titrasi, yaitu: Contoh: 1. Untuk menetralkan 50 mL larutan NaOH diperlukan 20 mL larutan 0.25 M HCl. Jawab: NaOH(aq) + HCl(aq) NaCl(aq) + H2O(l) 2. Sebanyak 0.56 gram kalsium oksida tak murni dilarutkan ke dalam air. Larutan ini tepat dapat dinetralkan dengan 20 mL larutan 0.30 M HCl.Tentukan kemurnian kalsium oksida (Ar: O=16; Ca=56)! Jawab: CaO(s) + H2O(l) Ca(OH)2(aq)
|
Pemilihan indikator untuk titrasi
Harus diingat bahwa pada titik ekivalen titrasi, jumlah mol asam sama dengan jumlah mol basa. Dibutuhkan pemilihan indikator yang sesuai dengan perubahan warna mendekati titik ekivalen. Indikator yang dipilih bervariasi dari satu titrasi ke titirasi yang lain.
Asam kuat vs basa kuat
Diagram berikut menunjukkan kurva pH untuk penambahan asam kuat pada basa kuat. Bagian yang diarsir pada gambar tersebut adalah rentang pH untuk jingga metil dan fenolftalein

Dapat dilihat bahwa tidak terdapat perubahan indikator pada titik ekivalen.
Asam kuat vs basa lemah
Perhatikan diagram berikut :

Kali ini adalah sangat jelas bahwa fenolftalein tidak dapat dipakai untuk menentukan titik ekivalen. Akan tetapi metil jingga mulai berubah dari kuning menjadi jingga sangat mendekati titik ekivalen, maka indikator yang tepat adalah metil jingga.
Asam lemah vs basa kuat
Perhatikan diagram berikut :

Pada reaksi ini, metil jingga tidak dapat digunakan untuk menentukan titik ekivalen. Akan tetapi, fenolftalein berubah warna dengan tepat pada pH yang anda inginkan. Jadi, untuk reaksi antara asam lemah dengan basa kuat dapat digunakan indikator pp.
Asam lemah vs basa lemah
Kurva berikut adalah untuk reaksi antara asam lemah dan basa lemah yang nilai Ka dan Kbnya sebanding (sama) contohnya, asam etanoat dan larutan amonia. Pada kasus yang lain, titik ekivalen akan terletak pada pH yang lain.

Dapat dilihat bahwa indikator phenolpthalein dan metil jingga tidak dapat digunakan. Phenolpthalein akan berakhir perubahannya sebelum tercapai titik ekivalen, dan jingga metil jauh ke bawah sekali.
Ini memungkinkan untuk menemukan indiaktor yang perubahan warnanya berada di sekitar titik ekivalen.
Nah, itu tadi sedikit pembahasan tentang titrasi asam basa. semoga membantu…