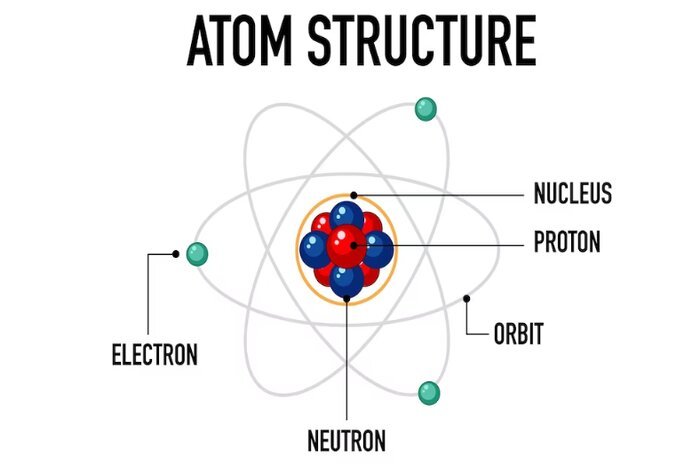
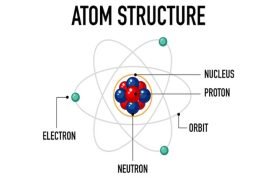
Atom, istilah yang sangat familiar ketika belajar ilmu kimia. Layaknya sel yang menjadi bagian terkecil dari strukur makhluk hidup, semua zat/materi juga memiliki bagian terkecil yang disebut atom. Seorang pemikir dari Yunani bernama Democritus berpendapat bahwa jika suatu materi dibagi menjadi bagian yang lebih kecil kemudian terus dibagi lagi maka akan sampai pada suatu keadaan di mana materi itu tidak dapat dibagi lagi.. Democritus mencetuskan istilah atom yang berasal dari bahasa Yunani, ‘a’ artinya tidak dan ‘tomos’ artinya ‘tak terbagi’. Jadi,atom sudah tidak dapat dibagi – bagi lagi.
Akan tetapi, pemikiran Democritus yang tidak didasarkan pada eksperimen tersebut tidak dapat menggambarkan bagaimana bentuk/struktur atom yang sebenarnya. Kemudian, John Dalton merumuskan teori atom yang berhasil menjelaskan hukum-hukum dasar kimia, yaitu hukum kekekalan massa, hukum perbandingan tetap, dan hukum kelipatan perbandingan. Teori atom Dalton ini memberikan gambaran model atom seperti model bola pejal atau model bola billiard. Model bola pejal hanya bertahan sampai tahun 1897, setelah ditemukannya elektron melalui percobaan sinar katoda oleh J.J. Thomson. Penemuan elektron ini kemudian menjadi dasar bagi Thomson untuk mengemukakan model atom. Menurut Thomson, elektron bermuatan negatif tersebar dalam bola bermuatan positif seperti model roti kismis, di mana kismis-kismis adalah elektron-elektron, dan roti adalah bola bermuatan positif.
Teori atom Thomson bertahan hingga 1911 setelah dilakukannya eksperimen penembakkan partikel α — partikel bermuatan positif — pada lempeng emas tipis oleh Ernest Rutherford. Ia menemukan bahwa ada sebagian partikel yang mengalami pembelokan bahkan terpantulkan. Kemudian Rutherford mengajukan model atomya yaitu: model inti, di mana dalam atom yang sebagian besar merupakan ruang kosong terdapat inti yang padat pejal dan masif bermuatan positif yang disebut sebagai inti atom; dan elektron-elektron bermuatan negatif yang mengitari inti atom.
Selanjutnya, pada tahun 1913, Niels Bohr mengajukan model atom hidrogen untuk menjelaskan fenomena spektrum garis atom hidrogen. Bohr menyatakan bahwa elektron-elektron bermuatan negatif bergerak mengelilingi inti atom bermuatan positif pada jarak tertentu yang berbeda-beda. Setiap lintasan orbit elektron berada tingkat energi yang berbeda; semakin jauh lintasan orbit dari inti, semakin tinggi tingkat energi. Lintasan orbit elektron ini disebut juga kulit elektron. Elektron yang tidak berpindah kulit akan mempunyai energi yang tetap. Sedangkan, elektron yang berpindah ke tingkat energi yang lebih rendah akan memancarkan/melepaskan energi dan elektron yang berpindah ke tingkat energi yang lebih tinggi akan menyerap energi.
Model atom Bohr hanya dapat menjelaskan spektrum garis atom unsur – unsur ringan saja,khususnya hidrogen. Karena itu, dicetuskan model atom mekanika kuantum oleh Erwin Schrödinger yang dipakai hingga saat ini. Teori atom mekanika kuantum didasari oleh hipotesis Louis de Broglie yaitu teori dualisme sifat dan asas ketidakpastian Heisenberg.
Untuk dapat lebih memahami tentang teori atom mekanika kuantum, ayorajinbelajar.com membagikan file dalam bentuk ppt yang diharapkan dapat membantu rekan – rekan dalam memahami teori atom mekanika kuantum. Rekan – rekan dapat mengunduhnya pada link download di bawah ini :